Оценка эффективности лечения суставов
В настоящее время обязательным компонентом комплексной терапии остеоартроза (ОА) являются хондропротекторы, так как патогенетическую основу этого заболевания составляет дисбаланс процессов синтеза и резорбции суставных тканей, преимущественно гиалинового хряща и субхондральной кости [8,11,14,21]. Деструкция хряща чаще обусловлена профессиональной деятельностью человека, перегрузками суставов, спортивными травмами, нарушением обмена веществ, а не возрастным изнашиванием суставов [4,6]. Таким образом, ОА называется гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [1,8].
ОА имеет значительную распространенность, особенно в старших возрастных группах, где частота его встречаемости превышает 50% [20]. По эпидемиологическим данным, в США ОА, диагностированный врачами, имеется у 20 млн взрослых [12]. Наиболее значимым в наше время становится гонартроз, встречаемость которого в 2 раза чаще, чем коксартроза. Не менее важна утрата трудоспособности, как временная, так и стойкая: по количеству дней нетрудоспособности ОА сопоставим с сердечно–сосудистой патологией. Значительный процент инвалидизации при ОА коленных суставов обусловлен растущей частотой артропластики [6,9].
По современным представлениям, в основе ОА лежит множество эндогенных и экзогенных факторов. К первым соответственно относятся возраст, пол, дефекты развития, наследственная предрасположенность, а ко вторым – травмы, профессиональная деятельность, спортивная активность и избыточная масса тела. Поскольку многие факторы риска не являются модифицируемыми, ОА имеет тенденцию к прогрессированию заболевания [1,4].
В настоящее время выделяют 2 основные формы ОА: первичный (локализованный или генерализованный) и вторичный (посттравматический, обусловленный врожденными, метаболическими, эндокринными и рядом других заболеваний) [9,12].
Таким образом, современная терапия ОА представляет собой сложную комплексную задачу, включающую коррекцию нагрузок, использование дополнительной опоры, снижение массы тела, увеличение силы мышц, в целом представляющую собой программу физической реабилитации, и медикаментозную терапию, направленную на уменьшение боли и увеличение подвижности суставов [5,15]. Безусловно, методики лечения ОА коленных суставов более сложны, что послужило основанием для формулирования международных рекомендаций специальной Комиссии постоянного комитета Европейской антиревматической лиги (EULAR) по международным клиническим исследованиям 2003 г. В соответствии с этими рекомендациями при лечении ОА коленных суставов необходимо учитывать наличие факторов риска (ожирение, нежелательные механические факторы, повышенную физическую активность), наличие общих факторов риска (возраст, сопутствующие заболевания, прием медикаментозных препаратов различных групп), выраженность болевого синдрома и функциональной недостаточности суставов, наличие признаков воспаления, в том числе синовита, локализацию и степень структурных повреждений [1,9].
По данным доказательной медицины и мнению международных экспертов EULAR, комплексная терапия ОА должна включать препараты замедленного действия (глюкозамин сульфат, хондроитин сульфат, неомыляемые соединения авокадо/сои, диацереин и гиалуроновую кислоту). Сущность этого принципиально нового подхода к лечению ОА обусловлена воздействием этой группы препаратов на метаболические процессы хрящевой ткани и регенерацию репаративных возможностей хондроцитов [5,10,13,22]. Использование хондроитина, глюкозамина и гиалуронана (ГЛ) осуществляется в клинической практике с начала 1980–х гг. В настоящее время накоплена значительная научная база, представленная десятками контролируемых исследований с высоким уровнем доказательности 1А–1В, по данным Американского колледжа ревматологов (ACR) 2000, 2005 [3,9].
В комплексную терапию ОА, как было сказано выше, необходимо включать нефармакологическое лечение с регулярным образовательными программами, физическими упражнениями, поддерживающими средствами (фиксаторами коленного сустава, ортезами, палочками) [12,16]. К медикаментам симптоматического действия, способными устранять болевой синдром и понижать степень функциональной недостаточности, относятся парацетамол, нестероидные противовоспалительные препараты (НПВП), опиоидные анальгетики, местные аппликации с применением НПВП и капсаицина. При обострениях болевого синдрома в коленном суставе, особенно при наличии сопутствующего синовита, показаны внутрисуставные инъекции длительно действующих кортикостероидов [2,15,18].
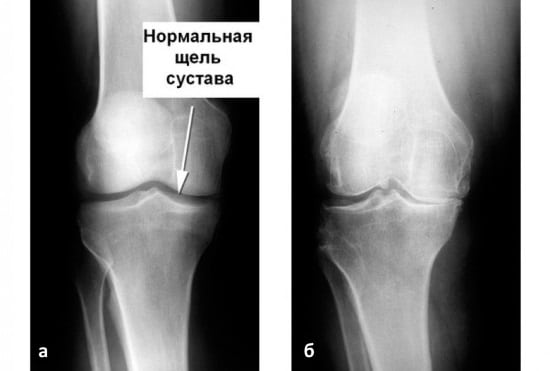
При проведении терапии ОА одной из ведущих задач является комплексное воздействие на дегенерирующий хрящ, теряющий амортизационные свойства (рис. 1). Патогенез ОА определяет значительное увеличение нагрузки на субхондральную кость с нарушением костного ремоделирования, развитием остеоида и появлением остеофитов [4,13].
Лечение хондроитин сульфатом (ХС) оказывает существенное влияние на процессы метаболизма различных структур сустава, воздействуя практически на все основные патогенетические механизмы развития ОА [7,14,21]. В первую очередь уменьшается гиперэкспрессия провоспалительных медиаторов, способствующих воспалительно–дегенеративным процессам в суставе и апоптозу хондроцитов, восполняющих синтез глюкозаминогликанов. Возможность ХС влиять на метаболизм хряща была продемонстрирована в годичном плацебо–контролируемом исследовании у больных ОА коленных суставов [22], при котором отмечалось достоверное снижение маркеров деградации хряща (кератан сульфата) и маркеров деструкции костной ткани (пиридинолина и дезоксипиридинолина). Не менее значим и симптом–модифицирующий эффект ХС, зарегистрированный как уменьшение боли по сравнению с монотерапией НПВП и улучшение функциональной способности суставов [22].
Особое место среди хондропротекторов занимают препараты гиалуроновой кислоты – гиалуронана (ГЛ), так как эти препараты вводятся в пораженные суставы [2,3,17]. Высокая частота поражения коленных суставов при ОА определяет необходимость дифференцированного подхода к назначению хондропротекторов: при полиостеоартрозе – системное назначение хондроитина и глюкозамина, а при локальных формах – ГЛ [3,19].
Гиалуронан в комбинации с коллагеном является основным компонентом протеогликана, то есть биополимера соединительной ткани (рис. 2).
Протеогликану присуща способность образовывать твердую среду гиалинового хряща. ГЛ обладает уникальными вязко–эластичными свойствами, присутствуя на поверхности суставного хряща и синовиальной оболочки, действует как любрикант и поглотитель механических сотрясений (рис. 2).
Гиалуронан, помимо любрикантных и демпферных свойств, используется хондроцитами в процессе синтеза протеогликанов гиалинового хряща [13]. Так, на рисунке 3 показаны функциональные и метаболические взаимосвязи синовиальной жидкости и суставного хряща, хондроцитами и хрящевым матриксом, где ведущая роль принадлежит гиалуронану. При остеоартрозе концентрация ГЛ снижается, молекулы синовиальной гиалуроновой кислоты укорачиваются, что уменьшает вязкость синовиальной жидкости (рис. 3).
Таким образом, очевидно показание для введения в пораженный сустав препаратов гиалуронана [3].
В проведенном нами исследовании у больных гонартрозом изучалась клиническая эффективность и переносимость комплексной терапии ОА ХС (как системным хондропротектором) и внутрисуставно вводимым препаратом Синокром (препаратом гиалуронана) в течение 6 мес. В открытое клиническое исследование после предварительно подписанного информированного согласия были включены 60 амбулаторных больных (мужчин 15 и женщин 45) в возрасте 42–68 лет (табл. 1). Пациенты были разделены на 2 группы. Больные 1–й группы получали ХС 500 мг 2 раза/сут. в течение 1–го месяца и 250 мг 2 раза/сут. в течение последующих 5 мес. Больным 2–й группы, принимавшим ХС по той же схеме, дополнительно внутрисуставно трижды с интервалом в 1 неделю вводился Синокром. По показаниям больные обоих групп в индивидуально подобранных дозировках принимали НПВП (диклофенак 100 мг/сут. при отсутствии гастроэнтерологической патологии, мелоксикам 15 мг/сут. при наличии язвенного анамнеза).
ОА диагностировался в соответствии с критериями ACR 1987. В обеих группах наблюдения преобладали 2 немодифицируемых фактора риска – наличие травмы в анамнезе и возрастной фактор, а также избыточная масса тела как модифицируемый фактор (рис. 4).
У обследованных больных оценивалась боль по ВАШ (100 мм визуально–аналоговой шкалы) в покое и при ходьбе, утренняя скованность в минутах, определялась функциональная недостаточность суставов (по опроснику WOMAC), оценивался терапевтический эффект, по мнению больного и врача, а также нежелательные явления при проведении терапии. Клинические показатели наблюдались до начала терапии, через 3 и 6 мес.
В результате проведенного исследования на фоне приема системной хондропротективной терапии ХС отмечалась положительная динамика при оценке болей по ВАШ как в покое, так и при ходьбе. Однако дополнительное внутрисуставное введение препарата Синокром через 3 мес. терапии показало статистически достоверное отличие от результатов динамики болевого синдрома в 1–й группе. На протяжении последующих 3 мес. анальгетический эффект пролонгировался дольше и также статистически достоверно отличался от результата пациентов в первой группе (рис. 5, 6).
Наблюдаемая нами динамика длительности утренней скованности у обследованных пациентов в группах наблюдения статистически достоверно не отличалась (табл. 2).
Для оценки функциональной активности больных нами изучалась динамика индекса WOMAC, которая была положительной у пациентов первой группы наблюдения, получавших системную терапию ХС. В то же время у больных ОА 2–й группы стабилизация состояния и расширение функциональных возможностей наблюдались с 3–го месяца комбинированной терапии, что обеспечивалось выраженным обезболивающим и противовоспалительным эффектом комплексной терапии, существенно и стойко оптимизировало функциональную активность (рис. 7).
Общая оценка эффективности лечения пациентом и врачом по итогам 6–мес. терапии представлена в таблице 3, результаты которой отражают улучшение функционального состояния коленных суставов на фоне проводимой фармакотерапии хондропротекторами, особенно при внутрисуставном введении Синокрома, при этом нет значительной разницы в оценке эффекта пациентом и врачом.
Оценивая переносимость комплексной терапии в группах наблюдения, следует отметить, что она была хорошей и отменялась в связи с побочными эффектами в обеих группах наблюдения. У 2 больных 1–й группы и у одной больной 2–й группы отмечались диспепсические явления, которые купировались коррекцией диеты, медикаменты не назначались.
По результатам проведенной терапии 6 больных (20%) 1–й группы и 10 больных (33,33%) 2–й группы смогли полностью отказаться от НПВП.
Таким образом, больным ОА необходимо включать в комплексную терапию хондропротекторы группы хондроитин сульфата и при локализованном поражении дополнительно вводить Синокром, так как указанными медицинскими препаратами обеспечивается эффективное воздействие на критические звенья патогенеза, болевой синдром и выраженность функциональной недостаточности.
Литература
1. Алексеева Л.И., Цветкова Е.С. Остеоартроз: из прошлого в будущее // Научно–практическая ревматология. №2. 2009, приложение. С. 31–37.
2. Бадокин В.В., Годзенко А.А., Корсакова Ю.Л. Локальная терапия остеоартроза // Лечащий врач. №10. 2007. С. 2–4.
3. Беленький А.Г. Препараты гиалуронана в лечении остеоартроза коленного и тазобедренного суставов Учебное пособие ГОУ ДПО РМАПО Росздрава от 23.04.2007.
4. Берглезов М.А., Андреева Т.М. Остеоартроз (этиология, патогенез) // Вестник травматологии и ортопедии им. Н.Н. Приорова.– 2006.– №4.– С. 79–86.
5. Везикова Н.Н. Оценка эффективности болезнь–модифицирующих препаратов и локальных методов терапии при остеоартрозе коленных суставов. Автореф. дисс. докт. мед. наук. Ярославль, 2005. 30 с.
6. Верткин А.Л., Алексеева Л.И., Наумов А.В. и др. Остеоартроз в практике врача–терапевта // РМЖ. 2008. Т.16. №7. С. 478–480.
7. Горячев Д.В. Место препаратов хондроитин сульфата в арсенале средств для лечения остеартроза // РМЖ. Т.16. №10, 2008. С. 3–7.
8. Клиническая ревматология. СПб., 2005. С. 386–388.
9. Клинические рекомендации. Остеоартрит. Диагностика и ведение больных остеоартритом коленных и тазобедренных суставов / Под ред. О.М. Лесняк.– М.: ГЭОТАР–Медиа, 2006. 176 с.
10. Насонова В.А., Алексеева Л.И. Архангельская Г.С. и др. Итоги многоцентрового клинического исследования препарата Структум в России. Новые возможности в лечении остеоартроза и остеохондроза. М., 2006. С. 5–7.
11. Насонова В.А., Эрдес Ш.Ф. О всемирной декаде костно–суставных заболеваний 2000–2010 // Научно–практическая ревматология. 2004. №4. С. 14–16.
12. Национальное руководство. Ревматология / Под ред. Е.Л. Насонова, В.А. Насоновой.– М.: ГЭОТАР–Медиа, 2008. С. 573–588.
13. Павлова В.Н., Капьева Т.Н., Слуцкий Л.И., Павлов Г.Г. Хрящ. М.: Медицина, 1998. 320 с.
14. Проценко Г.А. Хондропротекторы в комплексном лечении деформирующего артроза. Тезисы III съезда ревматологов. Научно–практическая ревматология, 2001. №3. С.98.
15. Рациональная фармакотерапия ревматических заболеваний. М., 2003. Т.3. С. 143–149.
16. Руководство для врачей. Школа здоровья. Остеоартрит / Под ред. О.М. Лесняк.– М.: ГЭОТАР–Медиа, 2008.– С.81–89.
17. Салихов И.Г., Волкова Э.Р., Якупова С.П. Периартикулярное применение хондропротекторов у больных гонартрозом с признаками поражения сухожильно–связочного аппарата // Consislium medicum. 2006. Т.8. №2. С.59–61.
18. Условия и требования к внутрисуставному и периартикулярному введению ГКС препаратов (метод. указания МЗ РФ №2001/25). М., 2001.
19. Цурко В.В. Местное лечение суставного синдрома при остеартрозе: рациональный выбор препарата и лекарственной формы // Справочник поликлинического врача. №8. 2006. С. 3–8.
20. Цурко В.В. Остеоартроз: гериатрическая проблема // РМЖ. Т.13. №24. 2005. С. 1627–1631.
21. Чичасова Н.В. Место медленнодействующих препаратов в рациональной терапии деформирующего остеоартроза // Consislium medicum. 2005. Т.7. №8. С. 634–638.
22. Чичасова Н.В. Хондроитин сульфат (Структум) в лечении остеоартроза: патогенетическое действие и клиническая эффективность // РМЖ. Т.17. №3. 2009. С. 3–7.
Источник
Остеоартрит (ОА) становится одной из наиболее распространенных болезней в современном обществе, поражая более 20% населения земного шара [1, 2]. Жалобы на боль и припухлость крупных суставов в 53,8% случаев обусловлены ОА [3]. Поздняя диагностика и малоэффективная терапия приводят к снижению качества жизни (КЖ) больных, ранней инвалидизации лиц трудоспособного возраста [4, 5]. По мере изучения патогенеза заболевания, внедрения новых методов диагностики стало ясно, что оно характеризуется хроническим воспалением, при котором в патологический процесс вовлечены все компоненты сустава, включая синовиальную оболочку, хрящ, суставную капсулу, связки, сухожилия, субхондральную кость [6]. Клинические симптомы ОА начинают проявляться при вовлечении в процесс иннервируемых тканей, что является одной из причин поздней диагностики [7]. Ключевым в патофизиологии ОА является синовит, для диагностики которого используют инструментальные методы, в частности, ультразвуковое исследование сустава, магнитно-резонансную томографию, а также гистологическое исследование биопсийного материала синовии. Синовит является предиктором повреждения хряща [8]. Поэтому заболевание имеет полное основание именоваться остеоартритом. Одним из главных механизмов патогенеза ОА является повреждение субхондральной кости с последующим нарушением костного ремоделирования, образованием остеофитов, субхондральным склерозом, что находит отражение при рентгенологическом исследовании суставов. От начала болезни до обращения к врачу проходит значительное время, что в первую очередь обусловлено медленным развитием болезни, ее стадийностью. Европейская антиревматическая лига (European League Against Rheumatism, EULAR) и Международное общество по изучению остеоартроза (Osteoarthritis Research Society International, OARSI) разработали рекомендации по лечению ОА, которые включают нефармакологические, фармакологические и хирургические методы [9, 10]. На ранней стадии болезни доминируют боль и припухание суставов, поэтому лечение должно быть направлено на их купирование с помощью нестероидных противовоспалительных препаратов (НПВП). Основными в лечении ОА являются медленнодействующие симптоматические препараты, которые в определенной степени уменьшают выраженность боли и в то же время оказывают хондропротективное действие. У больных ОА, особенно с гонартрозом и коксартрозом, установлены низкие показатели КЖ, что связано с хроническим, прогрессирующим течением заболевания. Учитывая пожилой возраст больных, прогрессирующее поражение суставов, можно сказать, что болезнь оказывает отрицательное влияние на важнейшие функции пациента — физическое, психологическое, социальное функционирование. Исследование КЖ позволяет проводить мониторинг состояния пациентов и оценивать динамику и эффективность лечения [11]. Благодаря развитию современных диагностических методов появилась возможность уточнения межсистемных взаимосвязей между воспалительными, сосудистыми и структурными изменениями в развитии заболеваний опорно-двигательной системы и научного обоснования алгоритмов диагностики и лечения больных с поражением суставного аппарата. Вместе с тем до настоящего времени практически не изучены особенности микроциркуляторных нарушений и системного гемостаза у пациентов с ОА [12]. Гиперкоагуляция у пациентов связана с функциональным состоянием эндотелия и иммунной системой. Повышенное содержание фибриногена, фактора Виллебранда, а также сниженная фибринолитическая активность плазмы связаны с прогрессированием атеросклероза и увеличением риска инфаркта и инсульта [13]. Сосудистая патология играет роль в инициации и прогрессировании ОА: эпизодически снижается приток крови через мелкие сосуды субхондральной кости. Поток крови может быть уменьшен путем венозной окклюзии и стаза, а также развитием микроэмболов в субхондральных сосудах. Есть несколько вероятных эффектов субхондральной ишемии: первый из них скомпрометирован недостатком питательных веществ и газообмена в суставном хряще и является потенциальным инициатором дегенеративных изменений в хрящевой ткани; второй связан с апоптозом остеоцитов, который будет инициировать резорбцию остеокластов этой кости и, по крайней мере временно, снижать костную поддержку вышележащего хряща. Необходимо учитывать эти факторы в целях разработки более эффективных методов лечения для подавления прогрессирования ОА [14]. Поскольку основным патогенетическим звеном ОА является потеря протеогликанов, для его лечения предлагается ряд препаратов, механизм действия которых направлен на возмещение потери или стимуляцию синтеза протеогликанов. Средство Остеокинг (биологически активная добавка к пище, не является лекарственным препаратом) может усиливать функцию гипофиз-адренокортикальной системы, тормозить функции гиалурата, хондроитиназы, гистамина, 5-гидрокситриптамина и простагландинсинтетазы, для оказания большего противовоспалительного, противоотечного и обезболивающего эффектов. Средство ингибирует синтез фермента тромбоксан А2, снижает синтез и активность фосфодиэстеразы, повышает уровень цАМФ, таким образом играя роль в торможении агрегации тромбоцитов, подавляя тромбообразование. Блокируя кальциевые каналы и внутриклеточное выделение кальция, средство способствует расширению спазмированных сосудов, улучшает микроциркуляцию и увеличивает доставку кислорода к поврежденным тканям. Таким образом, оно улучшает кровообращение и микроциркуляцию, стимулирует синтез костных клеток, увеличивает образование костных трабекул, стимулируя срастание и повышая плотность костей; обладает гиполипидемическим, фибринолитическим, антикоагулянтным и противовоспалительным действием [15]. Понимание механизма регуляции процессов поддержания гомеостаза суставных тканей, а также знание ведущих патогенетических процессов необходимы для оптимизации лечения дегенеративных и воспалительных заболеваний опорно-двигательного аппарата.
Целью настоящей работы было изучить динамику параметров системы гемостаза для оценки эффективности применения средства Остеокинг в амбулаторных условиях.
Материал и методы исследования
Исследование выполнено в условиях амбулаторного приема на базе ГБУЗ НСО ГКБ № 34, город Новосибирск. Под наблюдением находилось 52 пациента с гонартрозом в стадии обострения. Трое в дальнейшем выбыли из исследования в связи с отзывом информированного согласия. Пациенты участвовали в клиническом исследовании в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации. Диагноз ОА устанавливали в соответствии с критериями, предложенными Институтом ревматологии РАМН [16] с учетом критериев Altman (1991) [17]. Определение основных коагуляционных тестов: активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПТИ), фибриноген, Хагеман-зависимый фибринолиз (ХЗФ), антитромбин III (АТ-III), волчаночный антикоагулянт (ВА) проводилось в стандартных условиях лаборатории гемостаза ФГБНУ НИИТПМ. Критерии исключения: предыдущие операции металлоимплантации в коленном суставе с неудаленными металлоимплантатами в области оперативного вмешательства; гнойно-воспалительные или другие инфекционные процессы в анамнезе (гнойный бурсит, остеомиелит и др.); грубая варусная или вальгусная деформация сустава, требующая использования аугментов, связанного типа эндопротеза или костной пластики; повреждение коллатеральных связок коленного сустав; поливалентная аллергия, подтвержденная специалистом; анкилоз сустава; ожирение 3-й ст., выраженная нейропатия седалищного, бедренного нервов; гемипарез; нарушения обмена веществ в кости в анамнезе; терапия кортикостероидами, цитостатиками; женщины в периоде менопаузы на стадии остеопороза с DEXA сканирования Т-балл < –2,5; злокачественно прогрессирующие нервно-мышечные заболевания; злокачественные новообразования; активная фаза гепатитов В и С; СПИД; психические заболевания; беременность; лактационный период; заболевания, сопровождающиеся выраженными нарушениями функции печени и почек; кроме того, любые состояния, которые могут отрицательно повлиять на исход лечения, по данным обследования, регламентируемые программой испытания или субъективной самооценкой пациента. Пациенты получали Остеокинг по 25 мл через день; с учетом массы тела и эффективности суточную дозу титровали. Продолжительность применения составила шесть месяцев. Контроль за эффективностью лечения осуществлялся ежемесячно, параметры системы гемостаза были оценены после полного курса. Статистическую обработку данных осуществляли с использованием компьютерной программы Statistica 17.0, определялся характер распределения количественных признаков методом Колмогорова–Смирнова. В случае нормального распределения вычислялось среднее значение (М) и стандартная ошибка среднего (m). Достоверность различия показателей оценивали по критериям Стьюдента, Пирсона (при нормальном распределении), в случаях отклонения распределения от нормального использовались непараметрические критерии (U-критерий Манна–Уитни, χ2, критерий знаковых рангов Уилкоксона). Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принимался равным 0,05.
Результаты исследования
Клиническая характеристика пациентов: большинство пациентов составили женщины: 40 из 49 пациентов (81,6%), средний возраст составил 53,16 ± 9,71 года. Длительность заболевания составила от 1 до 10 лет, а средняя длительность обострения 6,0 ± 1,5 нед. У большинства больных была установлена II рентгенологическая стадия ОА (по Kellgren–Lawrence) — 34 пациента (69,4%), рентгенологическая стадия III — у 15 пациентов (30,6)%. У всех 49 пациентов (100%) имел место гонартроз. Клинические признаки синовита и периартрита были обнаружены у 40 пациентов (81,6%). У большинства больных (90%) отмечалось ограничение объема движений, в большей степени сгибания, в пораженных коленных суставах. Результаты проведенных нами гемостазиологических параметров наблюдаемых пациентов до и после лечения представлены в табл.
Выявлена активация коагуляционного гемостаза, о чем свидетельствовало повышение уровня фибриногена (3,98 ± 1,11 г/л) на фоне обострения остеоартрита, что характерно для хронически протекающего микротромбоваскулита. Одним из основных показателей коагуляционного звена является уровень физиологических антикоагулянтов (АТ-III). Тромбинемия и снижение уровня АТ-III являются основными критериями текущего внутрисосудистого свертывания крови и являются основной причиной развития тромбогеморрагических осложнений, у этих больных также выявлена гиперкоагуляция по параметру АЧТВ: 36,32 ± 13,21 сек. Повышенный фибриноген может вызывать развитие сердечно-сосудистых заболеваний вследствие того, что он напрямую влияет на густоту крови, могут образовываться тромбы, препятствующие передвижению крови по сосудам. Фибринолитическая активность определяется по времени лизиса сгустков эуглобулиновой фракции под действием плазмина, активированного фактором XIIa. Удлинение времени лизиса свидетельствует о депрессии внутреннего механизма фибринолиза, связанного чаще всего с дефицитом или истощением плазменного прекалликреина, плазминогена, с дефицитом фактора XII. Такое истощение внутреннего механизма фибринолиза наблюдается при заболеваниях, сопровождающихся тромботическими или тромбогеморрагическими синдромами. На фоне указанной терапии через 24 нед отмечалось улучшение ряда показателей АЧТВ: 35,87 ± 9,11 сек (р = 0,04), фибриноген: 3,5 ± 1,19 г/л (р = 0,001), ХЗФ: 10,82 ± 5,98 (р = 0,02). Статистически значимой разницы при оценке ПТИ, АТ-III, ВА не получено. Регистрация побочных эффектов показала, что на фоне приема отмечалась лишь сухость во рту у трети пациентов. Оценка КЖ составила до лечения: 57,49 ± 21%, а после лечения: 78,82 ± 22,99% (p = 0,01). Таким образом, в результате длительного применения у пациентов преимущественно с II–III стадиями ОА крупных суставов средства Остеокинг параметры гемостаза изменялись достаточно наглядно.
Обсуждение
ОА — самое распространенное ревматическое заболевание, приводящее к ухудшению физического состояния больного, а хроническое, прогрессирующее течение и потеря трудоспособности вызывают проблемы психологического характера и ограничение социальной активности больного человека. Наиболее часто для лечения ОА применяются НПВП, которым наряду с облегчением боли, улучшением подвижности суставов присущи побочные эффекты, в том числе коагулопатия, проявляющаяся в виде желудочно-кишечных кровотечений (замедление агрегации тромбоцитов и синтеза протромбина). В связи с этим особое значение приобретает терапия так называемыми препаратами хондропротективной направленности, обладающими «структурно-модифицирующим воздействием на хрящ», фибринолитическим, антикоагулянтным, противовоспалительным действием. Такой вид терапии позволяет уменьшить болевой синдром, возвратить пациенту подвижность, улучшить КЖ, уменьшить прогрессирование ОА, вследствие улучшения микроциркуляции и оксигенации поврежденным тканям. В нашем исследовании применение средства Остеокинг достоверно улучшило клиническую симптоматику ОА и положительно повлияло на КЖ пациентов. Поэтому при назначении терапии необходимо оценивать исходные показатели гемостаза и проводить лабораторный мониторинг данных показателей на фоне лечения.
Выводы
Таким образом, нарушения различных звеньев системы гемостаза у пациентов с синовитом могут протекать в качестве хронического компенсированного внутрисосудистого свертывания крови, микротромбоваскулита с нарушениями кинетики конечного этапа свертывания крови и умеренным снижением уровня физиологического антикоагулянта. Средство Остеокинг показало достаточно высокую терапевтическую эффективность у пациентов с ОА коленных суставов преимущественно II–III стадий в условиях амбулаторного лечения, достоверно улучшало гемостазиологические параметры: АЧТВ, фибриноген, ХЗФ, а также КЖ. При применении средства Остеокинг клинический эффект оценивался через 6 месяцев терапии.
Литература
- Фоломеева О. И., Эрдес Ш. Ф., Насонова В. А. Ревматические заболевания у населения Российской Федерации в начале XXI века // Тер. арх. 2007; (12): 5–7.
- Заболеваемость взрослого населения России в 2011 г. www.rosminzdrav.ru.
- Эрдес Ш. Ф., Галушко Е. А., Бахтина Л. А. и др. Распространенность артралгий и припухания суставов у жителей разных регионов РФ // Научно-практическая ревматология. 2004; (4): 42–46.
- Oberhauser C., Escorpizo R., Boonen A. et al. Statistical validation of the brief International Classiffication of Functioning, Disability and Health Core Set for Osteoarthritis based on a Large International Sample of patients with Osteoarthritis // Arthritis Care Res. 2013; 65 (2): 177–186. DOI: 10.1002/acr.21775.
- Janssen I., Mark A. E. Separate and combined influence of body mass index and waist circumference on arthritis and knee osteoarthritis // Int. J. Obesity. 2006; (30): 1223–1228.
- Workman J., Thambyah A., Broom N. The influence of early degenerative changes on the vulnerability of articular cartilage to impact-induced injury // Clin Biomech (Bristol, Avon). 2017; (43): 40–49. DOI: https://dx.doi.org/10.1016/j.clinbiomech.2017.01.003.
- Bijlsma J. W., Borenbaum F., Lafeber F. P. Osteoarthritis: an update with relevance for clinical practice // Lancet. 2011; 377 (9783): 2115–2126. DOI: 10.1016/S0140–6736 (11)60243–2.
- Sellam J., Berenbaum F. The role of synovitis in pathophysiology and clinical symtoms of osteoarthritis // Nat rev Rheumatol. 2010; 6 (11): 625–635. DOI: 10.1038/nrrheum.2010.159.
- Hochberg M. C., Altman R. D., April K. T. et al. ACR 2012 recommendations for the use of nonfarmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee // Arthr Care Res (Hoboken). 2012; (64): 465–474.
- Beaufils P., Becker R., Kopf S., Englund M., Verdonk R., Ollivier M., Seil R. Surgical management of degenerative meniscus lesions: the 2016 ESSKA meniscus consensus // Knee Surg Sports Traumatol Arthrosc. 2017 Feb 16. DOI: 10.1007/s00167–016–4407–4.
- Цапина Т. Н., Эрдес Ш. Ф., Слизкова К. Ш. Качество жизни больных остеоартрозом // Научно-практическая ревматология. 2004; (2): 20–22.
- Коршунов В. Г, Пучьянин Д. М., Шахмаратова С. Г. Эндотелиальная дисфункция и система гемостаза при остеоартрозе тазобедренного сустава и его эндопротезировании // Тромбоз, гемостаз и реология. 2016; (2): 47–54.
- Findlay D. M. Vascular pathology and osteoarthritis // Rheumatology (Oxford), 2007; 46 (12): 1763–1768.
- Bellamy N., Ruggeri Z. M. Von Willebrand factor, platelets and endothelial cell interaction // Thromb. Haemost. 2003; 1 (7): 1335–1342.
- Zhao H. B., Hu M., Zheng H. Y., Liang H. S., Zhu X. S. Clinical study on effect of Osteoking in preventing postoperational deep venous thrombosis in patients with intertrochanteric fracture // Chin J Integr Med. 2005; 11 (4): 297–299.
- Бунчук Н. В. Диагностические критерии остеоартроза коленных суставов // Consilium medicum. 2002; (8): 396–399.
- Altman R. D. Criteria for classification of clinical osteoarthritis // J Rheumatol Suppl. 1991; (27): 10–12.
Н. Н. Чапаева*, 1, доктор медицинских наук, профессор
Ю. С. Бахарева**
* ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
** ФГБНУ НИИТПМ, Новосибирск
1 Контактная информация: n.chapaeva@mail.ru
Купить номер с этой статьей в pdf
Источник