Современные подходы к лечению рака предстательной железы
В последнее время произошли существенные изменения не только в ранней диагностике рака предстательной железы (РПЖ), о чем мы уже писали в «МВ» (№47 от 23.11.06 г.), но и в подходах к лечению.
Уникальной чертой РПЖ является существование двух форм заболевания: гистологической (латентной), которая часто встречается у пожилых мужчин (особенно старше 80 лет), и клинической, инвазивной. Только каждый 10-й случай латентного рака становится болезнью с клиническими симптомами.
Лечение РПЖ зависит от распространенности опухоли, возраста больного, сопутствующих заболеваний и пожеланий пациента относительно предстоящей терапии. Необходимо принимать во внимание степень дифференцировки опухоли, уровень простат-специфического антигена (ПСА) до лечения и его динамику после. Поскольку РПЖ, особенно в начальных стадиях — медленно протекающее заболевание, во многом выбор метода оказания помощи определяет предполагаемая продолжительность жизни больного. Например, при локализованном РПЖ у пациента, который из-за возраста или сопутствующих заболеваний может прожить менее 10 лет, желательно избегать активного вмешательства, поскольку в течение данного отрезка времени болезнь не успеет прогрессировать.
Существует 4 основных метода лечения первичного РПЖ: выжидательная тактика (динамическое наблюдение), хирургическое, лучевое и гормональное.
Динамическое наблюдение
Применяется при обнаружении очень маленьких фокусов высокодифференцированного рака в предстательной железе, что может представлять собой т.н. «гистологический РПЖ», который почти никогда не развивается в «клинический»; при бессимптомном раке — у очень пожилого либо страдающего тяжелой болезнью пациента, а также у любого больного, который отказывается от активного вмешательства из-за нежелания подвергаться риску побочных эффектов.
В таких случаях после постановки диагноза лечение не проводится до развития симптомов рака либо признаков, говорящих о прогрессировании РПЖ (например, рост ПСА). Подход получил распространение после анализа результатов наблюдения за пожилыми мужчинами с локализованными высокодифференцированными опухолями в скандинавских странах: активации РПЖ не происходило в течение длительного времени, и большинство больных умирали от других, преимущественно сердечно-сосудистых заболеваний. Основная проблема — точность оценки предполагаемой продолжительности жизни конкретного пациента и риска прогрессирования РПЖ за этот период.
Радикальные подходы
Радикальная простатэктомия — полное удаление предстательной железы с простатической частью уретры и семенными пузырьками. Выполняется через надлобковый разрез (позадилонная простатэктомия) или промежностным доступом. Чаще используется позадилонный доступ, позволяющий выполнить тазовую лимфаденэктомию. Промежностная операция менее травматична, однако не дает возможность уточнить состояние тазовых лимфоузлов. Сочетание ее с лапароскопической тазовой лимфаденэктомией может решить проблему.
Приобретает популярность лапароскопическая радикальная простатэктомия, проводимая с использованием сложных робототехнических систем, управляемых хирургом дистанционно. Их применение упрощает манипулирование инструментами, не требует длительного обучения приемам лапароскопической хирургии на местах, позволяет проводить операции на большом расстоянии (в 2001 г. таковая впервые была осуществлена пациенту в Страсбурге (Франция) хирургом, находившимся в Нью-Йорке: он отдавал команды роботу, который выполнял все манипуляции).
Особенность хирургического лечения — невозможность удалить предстательную железу с широким иссечением окружающих тканей. Близкое расположение структур, которые необходимо сохранить во избежание значительного ухудшения качества жизни больного после операции — наружного сфинктера мочевого пузыря, прямой кишки, мочевого пузыря и мочеточников — ограничивает возможность радикального удаления опухоли, прорастающей капсулу предстательной железы. Толщина клетчатки, окружающая ее, составляет всего несколько миллиметров, поэтому классическим подходом служил отбор для радикальной простатэктомии только опухолей, не выходящих за пределы капсулы (Т1–Т2). Учитывая медленное прогрессирование РПЖ даже без лечения, выполнение данной операции обоснованно только у больных, которые по своему возрасту и состоянию здоровья способны прожить более 10 лет. Тем не менее, накопленный опыт показывает, что хорошие результаты операции могут быть получены и при местно-распространенных и даже при опухолях с метастазами в тазовых лимфоузлах, если хирургическое лечение сочетать с гормональным и/или лучевым.
Летальность после радикальной простатэктомии не превышает 0–1,5%. Наиболее частые послеоперационные осложнения — импотенция, недержание мочи, стриктура пузырно-уретрального анастомоза, мочевые свищи, тромбоэмболия легочной артерии. Эпизоды недержания мочи наблюдаются почти у всех больных в послеоперационном периоде, но купируются в течение 9 мес. после операции. Стойкое недержание более 1 года обычно сохраняется и далее. Эффективным методом его лечения является имплантация искусственного мочевого сфинктера. Для предотвращения импотенции выполняют простатэктомию с сохранением кавернозных нервов, однако такой подход может ухудшить радикальность операции.
Лучевая терапия
При лечении локализованного и местно-распространенного РПЖ могут использоваться дистанционное облучение и интерстициальная лучевая терапия (брахитерапия).
Дистанционное облучение предстательной железы и окружающей клетчатки проводится с четырех полей. Разовая доза — 1,8–2,0 Гр, суммарная — 60–64 Гр.
Совершенствование методов планирования и технического обеспечения лучевой терапии привело к внедрению т.н. конформного облучения, которое обеспечивает точное соответствие объема облучения пораженному органу. Для его проведения необходимо получить трехмерное изображение предстательной железы и соседних органов при помощи реконструкции КТ-сканов. Затем производится планирование полей облучения с использованием специальных компьютерных программ, целью которого является обеспечение доставки возможно большей дозы к предстательной железе при возможно меньшей дозе облучения, приходящейся на мочевой пузырь и прямую кишку. Модуляция интенсивности лучевой терапии, достигаемая благодаря многолепестковому коллиматору, позволяет еще точнее распределять дозу облучения в необходимом объеме ткани. Эти технологические достижения дают возможность использовать бльшие дозы облучения (около 70 Гр) без увеличения осложнений. Поскольку считается, что эффект лучевой терапии дозозависим, одним из направлений улучшения ее результатов является эскаляция дозы. Ряд исследователей продемонстрировали возможность подведения дозы свыше 80 Гр без существенной токсичности и с лучшими результатами, преимущественно среди больных с местно-распространенным РПЖ.
Близость прямой кишки, мочевого пузыря, кавернозных нервов и полового члена к предстательной железе обусловливает спектр осложнений лучевой терапии: постлучевые ректиты, циститы, эректильная дисфункция. Поздние постлучевые циститы могут сопровождаться учащением мочеиспускания, уменьшением емкости мочевого пузыря, периодической макрогематурией из расширенных сосудов его слизистой. Постлучевые ректиты проявляются болями в прямой кишке при дефекации и вне ее, кровотечением, частым жидким стулом. В отличие от быстрого развития импотенции после радикальной простатэктомии, после лучевой терапии это осложнение наступает постепенно.
Внутритканевая лучевая терапия (брахитерапия) получила распространение в последние годы благодаря техническому обеспечению и использованию новых радиоактивных источников. Преимущество — возможность подведения очень большой дозы к железе (до 160 Гр) без существенных побочных эффектов из-за быстрого поглощения энергии облучения окружающими тканями. Применяются две методики — высоко- и низкодозного облучения.
При высокодозном используется кратковременное воздействие изотопом иридия-92. Часто сочетается с дистанционной лучевой терапией.
Низкодозная брахитерапия — это перманентная имплантация изотопов палладия-103 или йода-125 в предстательную железу. Период полураспада 103Pd — 17 дней, 125I — 60. Таким образом, предстательная железа облучается в течение 3 или 10 месяцев — в зависимости от используемого изотопа. Зерна с изотопом имплантируются в простату по специальным иглам, которые под контролем ТрУЗИ вводятся в простату через кожу промежности. Кроме обычных осложнений лучевой терапии, при таком лечении часто развивается острая задержка мочи, что требует длительной катетеризации мочевого пузыря.
Кастрация — хирургическая или медикаментозная?
Стала широко использоваться после работ Huggins и Hodges в 1941 г., показавших, что гормональное лечение в форме кастрации либо приема эстрогенов приводит к клиническому улучшению (исследования были отмечены Нобелевской премией).
Наибольшее количество андрогенов (преимущественно тесто-стерона) вырабатывается в яичках клетками Лейдига, и лишь 5–10% — в надпочечниках. Функционирование клеток Лейдига регулируется лютеинизирующим гормоном (ЛГ) гипофиза, продукция которого, в свою очередь, стимулируется рилизинг-гормоном лютеинизирующего гормона (ЛГРГ), вырабатываемым в гипоталамусе. Существует механизм отрицательной обратной связи, когда низкие уровни тестостерона в крови стимулируют выработку ЛГРГ, что приводит к усилению выработки ЛГ и повышению уровня тестостерона. Секреция андрогенов надпочечниками регулируется адренокортикотропным гормоном. Синтез самого активного андрогена — 5a-дигидротестостерона — происходит путем трансформации тестостерона при участии фермента 5a-редуктазы, содержащегося в ткани предстательной железы. Свое действие андрогены реализуют путем связывания с внутриклеточным рецептором, после чего комплекс рецептор-гормон взаимодействует с определенными участками ДНК, стимулируя ее транскрипцию.
Сегодня есть ряд методов воздействия на эту систему с целью лишения клеток РПЖ андрогенной стимуляции, которые включают хирургическую или медикаментозную кастрацию, блокаду андрогенов на уровне клеток-мишеней, максимальную и интермиттирующую андрогенную блокаду.
Хирургическая кастрация, предложенная еще в 1941 г., остается и в наше время «золотым стандартом» гормонального лечения распространенного РПЖ. Двухсторонняя орхиэктомия быстро снижает уровень андрогенов в крови до очень небольших значений (т.н. кастрационный уровень тестостерона) путем элиминации из организма больного клеток Лейдига. Это — малотравматичный, эффективный и дешевый метод гормонального лечения. Побочные воздействия — снижение либидо и потенции, общая слабость, утомляемость, анемия, потеря мышечной силы, остеопороз, приливы и гинекомастия.
Медикаментозная кастрация достигается путем назначения эстрогенов либо аналогов ЛГРГ, что вызывает снижение уровня тестостерона в крови до кастрационных значений.
Эстрогены из-за выраженной кардиотоксичности высоких доз сейчас используются крайне редко: несмотря на эффективное снижение уровня тестостерона при их длительном применении, отмечается увеличение смертности от ССЗ.
Распространение получили аналоги (агонисты) ЛГРГ, обладающие большим сродством к рецептору, чем эндогенный ЛГРГ. Связывание аналога ЛГРГ с рецептором в гипофизе приводит к выбросу ЛГ с последующим истощением его выработки, что ведет к первоначальному подъему, а затем снижению уровня тестостерона в крови до кастрационных значений. Эта первоначальная стимуляция выработки ЛГ и тесто-стерона получила название феномена «вспышки». Клинически у больного распространенным РПЖ он может проявиться обострением симптоматики в течение первых нескольких недель лечения, усилением костных болей, иногда приводит к патологическим переломам костей и даже смерти. Для предотвращения осложнений рекомендуется назначать антиандроген одновременно или за 1 неделю до введения аналога ЛГРГ и принимать в течение первого месяца лечения. Чаще назначаются такие аналоги ЛГРГ, как гозелерин (золадекс), люпрорелин (люпрон), трипторелин и буселерин. Созданы депо-формы этих препаратов, требующие введения 1 раз в 4 или 12 недель. Эффективность применения аналогов ЛГРГ примерно равна таковой при хирургической кастрации; то же можно сказать и о побочных воздействиях. Это позволяет считать данный метод гормонотерапии «стандартным» при лечении распространенного РПЖ. Преимущество — психологический эффект (сохранение яичек), а также полная обратимость эффекта при отмене препарата. Недостаток — высокая стоимость лечения.
Блокада андрогенов на уровне клеток-мишеней стала возможна с появлением нового класса препаратов — антиандрогенов (стероидных и нестероидных).
Нестероидные, или «чистые» антиандрогены проявляют свое действие только на уровне рецепторов к андрогенам. Блокада в гипоталамусе таких рецепторов, отвечающих за механизм обратной связи, приводит к повышению в крови уровней ЛГРГ, ЛГ и тестостерона. Предполагается, что этот эффект может способствовать сохранению либидо и потенции при использовании данных препаратов. В настоящее время применяются три нестероидных антпандрогена: флутамид (флуцином, флютаплекс), нилютамид (анандрон) и бикалутамид (касодекс). Они могут использоваться в комбинации с медикаментозной или хирургической кастрацией либо самостоятельно (монотерапия). Интерес к монотерапии антиандрогенами вызван стремлением снизить количество и тяжесть побочных эффектов кастрации (особенно такого грозного осложнения, как остеопороз) и сохранить половую функцию. При лечении местно-распространенного и метастатического РПЖ с хорошим прогнозом эффективность антиандрогенов, прежде всего бикалутамида, сравнима с кастрацией. Что касается побочных эффектов, то при монотерапии бикалутамидом такие показатели качества жизни, как либидо, сексуальная функция, жизненная энергия, эмоциональное благополучие и физические возможности оказались выше, чем при стандартном лечении. Недостатком антиандрогенов первого поколения является их относительно высокая токсичность, выражающаяся в нарушении функции печени, тошноте, рвоте, диарее и гинекомастии.
Стероидные антиандрогены наряду с блокадой андрогенных рецепторов оказывают центральный антигонадотропный эффект, приводящий к снижению уровня тестостерона при их использовании. Основным представителем этого класса препаратов является ципротерона ацетат (ЦПА) (андрокур). Побочные эффекты препарата — снижение либидо и потенции, нарушение функции печени. Сердечно-сосудистые осложнения развиваются редко; что касается приливов и гинекомастии, то в малых дозах препарат способен пред-отвращать эти явления. В целом, при использовании ЦПА отмечается меньше побочных эффектов, чем при лечении флутамидом. Эффективность монотерапии ЦПА изучена недостаточно.
Максимальная (комбинированная) андрогенная блокада (МАБ) — вид гормонального лечения, при котором хирургическая или медикаментозная кастрация сочетается с приемом стероидных либо нестероидных антиандрогенов. Теоретическим обоснованием такого агрессивного лечения являлось предположение, что подавление надпочечниковых андрогенов, остающихся в крови после кастрации, при помощи антиандрогенов может улучшить результаты гормонального лечения РПЖ. В начальных исследованиях были показаны обнадеживающие результаты такого подхода, однако впоследствии выявились методологические погрешности в этих работах. Большое количество проведенных исследований, а также мета-анализ 27 рандомизированных исследований с участием 8275 больных не показал достоверных преимуществ МАБ перед стандартным лечением (хирургическая или медикаментозная кастрация) (см. график). В настоящее время осталось только два показания к использованию МАБ у первичных больных: профилактика феномена «вспышки» при лечении аналогами ЛГРГ; выраженная симптоматика, обусловленная распространенным РПЖ, высокими уровнями ПСА и щелочной фосфатазы. Поскольку при использовании МАБ наблюдается более выраженное и быстрое влияние на симптомы РПЖ и маркеры, в последней группе больных проведение МАБ в течение 3–6 мес. способствует более быстрому купированию болей и других признаков РПЖ, что улучшает качество жизни пациентов.

Гормональное лечение носит паллиативный характер, через некоторое время перестает быть эффективным и РПЖ становится гормоно-резистентным. На основании предположения, что периодически назначаемое гормональное лечение, в отличие от постоянного, может способствовать удлинению времени до наступления гормоно-резистентности, была предложена концепция интермиттирующей блокады андрогенов. При использовании такого подхода на первом этапе проводится индукционный курс МАБ с применением аналогов ЛГРГ, цель которого — снизить уровень ПСА. После достижения низких значений ПСА, лечение отменяется до тех пор, пока уровень ПСА не станет выше определенного значения (например, 20 нг/мл), после чего опять проводится МАБ. Курсы повторяются до тех пор, пока гормональное лечение способно снижать уровень ПСА. Хотя, по имеющимся в настоящий момент данным, интермиттирующая блокада андрогенов не превосходит стандартное лечение по эффективности, большим преимуществом его является улучшение качества жизни больных и снижение стоимости лечения.
Материал предназначен для урологов и онкологов.
Олег СУКОНКО, зав. отделом онкоурологической патологии, доктор мед. наук,
Источник
В обзоре рассматриваются разные подходык лечению рака предстательной железы в зависимости от его формы и имеющихся сопутствующих заболеваний и осложнений, приводится описание научных исследований в этом направлении.
Введение
Рак предстательной железы (РПЖ) занимает второе место в структуре онкологических заболеваний мужского населения Российской Федерации. В 2016 г. выявлено 38 371 новый случай этого заболевания и 12 523 случая
смерти от него [1]. По данным ВОЗ, в 2012 г. в мире выявлено 1 094 916 случаев РПЖ и 307 481 случай смерти [2]. Как правило, диагноз РПЖ выставляется на основании повышенного уровня простатического специфического антигена (ПСА), данных пальцевого ректального исследования и биопсии предстательной железы с оценкой площади поражения в положительных биоптатах и дифференцировки опухоли (оценка по шкале Глисона).
История появления и развития гормональной терапии (ГТ) РПЖ начинается в 1941 г., когда Чарльз Хаггинс (Charles Huggins) со своими учениками Кларенсом В. Ходжесом (Clarence V. Hodges) и Уильямом Уоллесом Скоттом (William Wallace Scott) выявили связь между андрогенами и клетками РПЖ. Далее, в 1971 г. Эндрю Шалли (Andrew V. Schally) выделил, определил структуру и синтез гонадотропин-рилизинг-гормона, за что в 1977 г. вместе с Рожем Гийменом (Roger Guillemin) получил Нобелевскую премию [3].
Согласно данным M. V. Meng et al., примерно 50% пациентов c РПЖ получают ГТ на определенных этапах лечения [4]. Однако, несмотря на несколько десятилетий клинического применения, по-прежнему существуют разногласия относительно андрогенной депривации (хирургическая или медикаментозная), времени начала ГТ (немедленное или отсроченное), точки приложения ГТ (в режиме максимальной андрогенной блокады или монорежиме), а также продолжительности и схемы назначения ГТ (постоянная или интермиттирующая).
Гормональная терапия локализованного и местно-распространенного РПЖ
ГТ локализованного РПЖ может быть предложена пациентам, которые отказываются от проведения хирургического лечения или лучевой терапии (ЛТ). По данным исследования Yu-Ning Wong et al., более высокая общая выживаемость наблюдается у пациентов в возрасте 65–80 лет, не получавших ГТ. В исследование было включено 16 535 пациентов с локализованным РПЖ высокой и умеренной степени дифференцировки. Критериями включения были: общая выживаемость >12 мес., отсутствие ЛТ или хирургического лечения в течение 6 мес. с момента постановки диагноза [5].
Аналогичные результаты получены в другом исследовании, включавшем 19 271 пациента в возрасте 66 лет и старше. При этом выявлено, что назначение ГТ по сравнению с наблюдением ухудшает показатель 10-летней выживаемости (80,1% против 82,6%). Однако при анализе выживаемости с учетом дифференцировки опухоли преимущество могут иметь пациенты с низкодифференцированным РПЖ (59,8% против 54,3%) [6].
В 2004 г., M. P. Wirth et al. изучали эффективность 150 мг бикалутамида у пациентов с локализованным и местно-распространенным РПЖ с категорией N0. В общей сложности 8113 пациентов были рандомизированы на 2 группы: 1-я группа получала бикалутамид в дозе 150 мг/сут (n=4052), 2-я группа — плацебо (n=4061) в дополнение к стандартной радикальной простатэктомии (РПЭ), ЛТ или активное наблюдение. При медиане наблюдения 5,4 года бикалутамид улучшил выживаемость без прогрессирования (ВБП), но не повлиял на общую выживаемость. При анализе подгрупп установлено, что общая выживаемость пациентов улучшилась в группе больных с местно-распространенным РПЖ и, наоборот, уменьшилась в группе пациентов с локализованным опухолевым процессом [7].
В настоящее время нет данных, показывающих преимущество ГТ у пациентов с РПЖ группы высокого риска. В исследовании EORTC 30891, включавшем 939 пациентов с РПЖ, разделенных на 2 группы в зависимости от немедленного или отсроченного начала ГТ, было показано преимущество ГТ у пациентов со стартовым уровнем ПСА >50 нг/мл и/или временем удвоения ПСА <12 мес. [8].
В скандинавском многоцентровом рандомизированном контролируемом исследовании SPCG-7/SFUO-3 (875 пациентов) и исследовании PR/PR07 (1205 пациентов) продемонстрировано улучшение общей выживаемости пациентов с местно-распространенным РПЖ при сочетании ГТ с ЛТ [9, 10].
У пациентов с ожидаемой продолжительностью жизни менее 5 лет ни РПЭ, ни ГТ не являются соответствующими вариантами лечения. Роль комбинированной терапии, включающей дистанционную ЛТ в сочетании с ГТ, до конца не определена в настоящее время, однако при индексе Глисона >8 баллов, при наличии местно-распространенной опухоли (>T3) и уровне ПСА >20 нг/мл использование дистанционной ЛТ и ГТ рекомендуется. Если ЛТ не может быть проведена, возможно назначение ГТ в режиме монотерапии [11]. На рисунке 1 приводится алгоритм лечения локализованного РПЖ [12].
![Рис. 1. Алгоритм лечения локализованного РПЖ [35] Рис. 1. Алгоритм лечения локализованного РПЖ [35]](https://www.rmj.ru/upload/medialibrary/ce0/36-1.png)
Биохимический рецидив после радикальной простатэктомии или лучевой терапии
У 20–40% пациентов после выполнения РПЭ и у 30–50% после ЛТ наблюдается биохимический рецидив в течение 10 лет [13–15]. Под биохимическим рецидивом после РПЭ подразумевается два последовательных повышения уровня ПСА >0,2 нг/мл, после ЛТ — повышение ПСА на 2 нг/мл от уровня надира [16, 17].
Наличие высокого стартового уровня ПСА, местно-распространенной опухоли, положительного края резекции (R1) и индекс Глисона ≥8 баллов повышают вероятность 10-летнего биохимического рецидива после РПЭ до 75% [18–20].
При развитии биохимического рецидива после РПЭ и уровне ПСА <1 нг/мл лучевая диагностика нецелесообразна ввиду низкой чувствительности; при уровне ПСА >1 нг/мл рекомендуется проведение позитронно-эмиссионной компьютерной томографии (ПЭТ/КТ) с 11С-холином или с простат-специфическим мембранным антигеном. Данные показатели ПСА определены Европейской ассоциаций урологов (EAU) в 2017 г., однако с накоплением достаточного опыта в диагностике эти значения могут быть пересмотрены в ближайшее время. При повышении уровня ПСА после предшествующей ЛТ и планировании сальважной терапии рекомендуется выполнение мультипараметрической магнитно-резонансной томографии для выявления суспициозных областей и проведения таргетной биопсии, а также ПЭТ/КТ для оценки лимфатических узлов и исключения отдаленных метастазов. Выполнять КТ-сканирование костей, органов грудной и брюшной полостей рекомендуется при уровне ПСА >10 нг/мл или времени удвоения ПСА <6 мес. и скорости прироста ПСА >0,5 нг/мл/мес. [21].
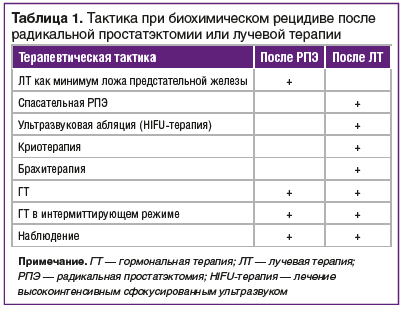
При обнаружении биохимического рецидива после РПЭ или ЛТ возможны определенные терапевтические подходы (табл. 1).
В настоящее время имеются противоречивые данные об эффективности ГТ у пациентов после предшествующего лечения первичной опухоли. В группе пожилых пациентов с наличием сопутствующих заболеваний побочные эффекты ГТ, такие как сердечно-сосудистые и тромбоэмболические осложнения, острая почечная недостаточность, наоборот, могут снизить продолжительность жизни [22–24].
Раннее назначение ГТ должно рассматриваться в применении к пациентам с высоким риском прогрессирования заболевания: время удвоения ПСА <6–12 мес., индекс Глисона >7 баллов и высокая оценка ожидаемой продолжительности жизни. В остальных случаях необходимо взвешивать ожидаемую пользу и возможные риски терапии [21]. На рисунке 2 приводится алгоритм лечения биохимического рецидива после РПЭ [12].
![Рис. 2. Алгоритм лечения биохимического рецидива после РПЭ [35] Рис. 2. Алгоритм лечения биохимического рецидива после РПЭ [35]](https://www.rmj.ru/upload/medialibrary/d72/36-3.png)
Гормональная терапия при вторичном поражении лимфатических узлов
Для больных с местно-распространенным заболеванием предстательной железы результаты исследований по поводу немедленной или отсроченной ГТ дискутабельны. Решение для бессимптомного пациента с местно-распространенным РПЖ должно быть принято индивидуально по каждому пациенту после оценки рисков и преимуществ. Нежелательные явления при ГТ (сердечно-сосудистые заболевания, резистентность к инсулину, риск костных переломов) также должны быть приняты во внимание.
Пациенты с малым объемом поражения лимфатических узлов (<2) имеют достаточно хороший прогноз выживаемости даже без проведения незамедлительной ГТ.
Группа авторов во главе с Seiler опубликовали результаты хирургического лечения (РПЭ с расширенной тазовой лимфаденэктомией) у больных с категорией pN+. Более чем половина больных (57%) имели лишь один метастаз в лимфатическом узле, и 10-летняя опухолево-специфическая выживаемость составила 75% без проведения ГТ.
К неблагоприятным факторам прогноза относят наличие более одного метастаза в области таза, выход за пределы капсулы лимфатического узла, плотность поражения лимфатических узлов более 20%, инвазию семенных пузырьков, индекс Глисона 8–10 баллов, ПСА >50 нг/мл, время удвоение ПСА <12 мес. Эти прогностические факторы должны учитываться при назначении ГТ.
Гормональная терапия при метастатическом РПЖ
Медиана выживаемости у больных с впервые выявленным метастатическим РПЖ составляет 42 мес. [25], однако популяция «М1» очень гетерогенна. Для оценки общей выживаемости были предложены прогностические факторы, включая число и локализацию костных метастазов, висцеральные очаги, сумму баллов по Глисону, оценку статуса по Карновскому, инициальный (стартовый) ПСА [26], уровень щелочной фосфатазы.
В клинических исследованиях наиболее частыми прогностическими факторами являются число и локализация костных метастазов, наличие висцеральных метастазов [27].
Гормональная терапия — интегральный компонент при начале системной терапии гормон-наивного метастатического РПЖ.
ГТ первоначально использовалась в монорежиме для лечения метастатического РПЖ [28, 29]. Новые препараты с иным механизмом действия позволили применять новые комбинации с ГТ: ГТ + абиратерон и ГТ + доцетаксел.
На момент написания статьи в мировой литературе отсутствуют данные, сравнивающие эффективность ГТ и химиотерапии препаратом доцетаксел с ГТ и абиратероном в рамках одного исследования. Оба препарата показали схожие данные по улучшению общей выживаемости.
Выбор препарата должен быть сделан после обсуждения с пациентом потенциальных нежелательных действий абиратерона (гипокалиемия, артериальная гипертензия, отеки, гепатотоксичность) и доцетаксела (угнетение красного костного мозга, фебрильные инфекции, нейропатия), стоимости лечения и доступности препарата в реальной клинической практике. На рисунке 3 приводится алгоритм лечения при метастатическом РПЖ [12].
![Рис. 3. Алгоритм лечения при метастатическом РПЖ [35] Рис. 3. Алгоритм лечения при метастатическом РПЖ [35]](https://www.rmj.ru/upload/medialibrary/79b/36-4.png)
Гормональная терапия + абиратерон
Cнижение эффективности ГТ может быть вызвано внутриклеточной конверсией предшественников стероидных гормонов в клетках РПЖ. Рациональность добавления абиратерона объясняется возможностью блокирования вышеуказанной конверсии.
Два крупных рандомизированных исследования продемонстрировали эффективность комбинации ГТ + абиратерон у больных гормон-наивным РПЖ.
Исследование LATITUDE
Исследование LATITUDE включало 1199 мужчин с впервые выявленным гормон-наивным метастатическим РПЖ. Пациенты были рандомизированы в зависимости от проводимого лечения на 2 группы: ГТ + АБИ + преднизон (исследуемая) и ГТ + плацебо (контрольная). Пациенты относились к группе высокого риска и имели как минимум 2 из 3-х критериев: индекс Глисона 8 баллов и более, хотя бы 3 костных образования или наличие измеряемых висцеральных очагов.
Общая выживаемость была значительно выше в исследуемой группе (недостигнутая медиана выживаемости против 34,7 мес., отношение рисков (ОР) 0,62, 95% ДИ: 0,51–0,76). Радиологическая ВБП была значительно выше при добавлении абиратерона (медиана 33,0 мес. против 14,8 мес., ОР 0,47, 95% ДИ: 0,39–0,55). Схожие преимущества в выживаемости наблюдались при анализе вторичных целей исследования: время до прогрессии боли, время до биохимического (ПСА) прогрессирования, время до развития симптомных скелетных событий, время до химиотерапии и время до последовательной терапиии РПЖ. Было зарегистрировано большее число нежелательных явлений III степени тяжести или выше: артериальная гипертензия (22% против 10%) и гипокалиемия (10% против 4%).
Исследование STAMPEDE
1917 мужчин рандомизированы на 2 группы: ГТ + АБИ + преднизон (исследуемая) и ГТ в монорежиме (контрольная). Популяция пациентов была гетерогенна и включала следующие категории:
впервые выявленное заболевание (94,9%). Сюда входила группа высокого риска (стадия T3-T4N0M) с ПСА ≥40 нг/мл или суммой баллов по Глисону 8–10 (26,6%), больные с пораженными лимфатическими узлами (N1M0 19,2%) и метастатическим заболеванием (M1 49,1%);
пациенты с рецидивом после лечения (РПЭ/ЛТ): с биохимическим рецидивом (1,9%) или метастатическим заболеванием (3,2%).
Главная цель исследования — общая выживаемость и ВБП. Анализ данных проводился при медиане наблюдения 14 мес. Общая выживаемость была значительно выше при применении комбинации препарата абиратерон (3-летняя выживаемость в исследуемой группе 83%, в контрольной — 76%; ОР 0,63, 95% ДИ: 0,52–0,76). Результаты были схожи как для метастатического, так и для локализованного местно-распространенного РПЖ.
ВБП была значительно выше в исследуемой группе (3-летняя ВБП составила 75% против 45% в контрольной; ОР 0,29, 95% ДИ: 0,25–0,34). Результаты были сопоставимы как для метастатического, так и для локализованного местно-распространенного РПЖ.
Гормональная терапия + доцетаксел
Результаты трех рандомизированных клинических исследований доказали эффективность (улучшение показателей общей выживаемости и ВБП) комбинации ГТ + доцетаксел у больных метастатическим гормон-наивным РПЖ. Однако улучшение выживаемости сопряжено с токсическими явлениями лекарственной терапии. Комбинация ГТ + доцетаксел по сравнению с ГТ в монорежиме вызывает больше нежелательных явлений, по данным всех трех исследований [27, 30, 31]. В исследовании STAMPEDE частота встречаемости нежелательных явлений III–V степени тяжести в исследуемой группе (доцетаксел) составила 52% против 32% в контрольной.
Частота встречаемости лейкопении, по данным всех трех исследований, составила 6–15%. В исследовании STAMPEDE было зарегистрировано 8 смертей, вероятно, ассоцированных с применением препарата доцетаксел, включая 5 смертей от нейтропенического сепсиса и 3 смерти от пневмонии. В исследовании GETUGAFU 15 было зарегистрировано 2 смерти от нейтропении.
Проведение гормональной терапии в сочетании с лучевой терапией
Комбинация ЛТ и ГТ аЛГРГ (бусерелином и др.) доказала свое преимущество по сравнению с ЛТ в монорежиме в ряде исследований [32–34]. Эти исследования включали больных РПЖ высокого риска, преимущественно местно-распространенным (T3–T4, N0-X), с учетом широкого спектра остальных параметров (ПСА, индекс Глисона). Результаты исследования EORTC 22863 позволили сделать проведение ЛТ + ГТ при местно-распространенном РПЖ стандартом лечения.
Анализ исследования RTOG 9408 и других ретроспективных работ продемонстрировал отсутствие выигрыша в выживаемости при добавлении ГТ аЛГРГ к ЛТ у больных РПЖ низкого риска.
Работа Ciezki et al. доказала, что добавление в течение 6 мес. ГТ к IMRT (лучевой терапии с модулированной интенсивностью) позволяет улучшить показатели выживаемости в группе промежуточного риска РПЖ [35].
Высокий риск прогрессирования заболевания вне облучаемой зоны требует комбинированного подхода: IMRT c эскалацией СОД (суммарной очаговой дозы, возможно с включением путей регионарного лимфоотока) с добавлением долгосрочной ГТ. При расчете длительности ГТ важно оценивать такие факторы, как общее состояние больного, сопутствующие заболевания, неблагоприятные прогностические факторы. Стоит помнить, что EBRT и краткосрочная ЛТ не улучшили общую выживаемость в группе больных РПЖ высокого риска в Бостонском исследовании RTOG 94–13 и 86–10. В настоящий момент пациентам из этих исследований рекомендована длительная ГТ.
Заключение
Назначение гормональной терапии при локализованном РПЖ не увеличивает выживаемость, напротив, может снизить ее ввиду нежелательных явлений.
Гормональная терапия является стандартом лечения при биохимическом рецидиве. Однако оптимальное время начала терапии остается открытым вопросом. Более молодым больным с риском раннего метастазирования (8–10 баллов по Глисону, время удвоение ПСА <10–12 мес.) целесообразно раннее назначение ГТ. У больных с более благоприятным течением заболевания возможно отсроченное лечение при условии информированного согласия больного и периодических контрольных обследований.
При категории pN+ пациенту целесообразно предложить гормональную терапию аЛГРГ. Больным с поражением менее 2-х лимфатических узлов, отсутствием выхода за пределы капсулы лимфатического узла и ПСА <0,1 нг/мл возможно проведение плановых контрольных обследований с назначением ГТ при необходимости.
Больным местно-распространенным или метастатическим РПЖ наиболее эффективно назначение гормональной терапии в комбинации с такими препаратами, как абиратерон, доцетаксел. Отсутствуют данные, сравнивающие эффективность ГТ и химиотерапии препаратом доцетаксел с ГТ и абиратероном в рамках одного исследования. Оба препарата показали схожие данные по улучшению общей выживаемости.
Выбор препарата должен быть сделан после обсуждения с пациентом потенциальных нежелательных действий ?