Псевдопапиллярная опухоль поджелудочной железы лечение
Лучевая диагностика солидной псевдопапиллярной опухоли поджелудочной железы
а) Терминология:
1. Сокращения:
• Солидная псевдопапиллярная опухоль (solid pseudopapillary neoplasm — SPN)
2. Синонимы:
• Солидная и папиллярная эпителиальная опухоль (solid and papillary epithelial neoplasm-SPEN); папиллярная кистозная эпителиальная опухоль; папиллярная кистозная опухоль; солидная и кистозная опухоль поджелудочной железы, опухоль Франца или опухоль Хамоди
3. Определения:
• Эпителиальная опухоль экзокринной части поджелудочной железы, сочетающая признаки солидного и кистозного новообразований и характеризуемая низким злокачественным потенциалом
б) Визуализация:
1. Общая характеристика:
• Основные диагностические признаки:
о Крупное округлое инкапсулированное сложное кистозное образование поджелудочной железы, не вызывающее расширения протоков
• Локализация:
о Обычно в хвосте поджелудочной железы
• Размеры:
о Обычно крупные (в среднем: 10 см; от 2,5 до 20 см)
• Морфология:
о Как правило, четко отграниченное крупное солидное и кистозное объемное образование
о Новообразования <3 см выглядят солидными, гомогенными
о Может содержать дистрофические кальцинаты
о Признаки агрессивного поведения опухоли встречаются нечасто, они включают в себя
— Периваскулярную инвазию, расширение протоков; метастазы обычно в печени, но также в лимфоузлах и по брюшине
2. УЗИ при солидной псевдопапиллярной опухоли:
• Хорошо отграниченное гетерогенное объемное образование, содержащее солидный и кистозный компоненты:
о Гипоэхогенный центр формируется вследствие некроза опухоли/кровоизлияния
о В кистозной части опухоли может определяться уровень жидкость-детрит
• Цветовая допплерография: слабая васкуляризация из-за участков некроза
• Эндоскопическое УЗИ: более чувствительный метод, позволяет выявлять мелкие опухоли:
о Может применяться как метод контроля при тонкоигольной биопсии

(Левый) При Т2 МРТ на аксиальной томограмме в теле поджелудочной железы определяется мелкое четко отграниченное Т2-яркое новообразование. Обратите внимание, что сигнал от опухоли менее интенсивный по сравнению с сигналом жидкого содержимого желчного пузыря и спинного мозга.
(Правый) При Т1 МРТ с контрастным усилением и подавлением жира на соответствующей томограмме в теле поджелудочной железы определяется мелкое слабо контраструемое объемное образование, симулирующее аденокарциному поджелудочной железы; но, в отличие от аденокарциномы, расширения панкреатического протока и инфильтрации окружающих тканей не наблюдается.
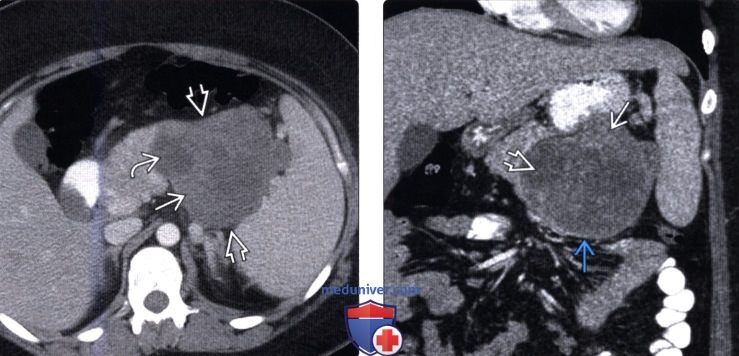
(Левый) У девушки 19 лет при КТ с контрастным усилением на аксиальной томограмме в теле поджелудочной железы визуализируется гетерогенное объемное образование, состоящее из солидного и кистозного компонентов.
(Правый) При КТ с контрастным усилением на соответствующей корональной томограмме визуализируется крупное, преимущественно кистозное объемное образование с контрастным пояском и мягкотканным компонентом на периферии.
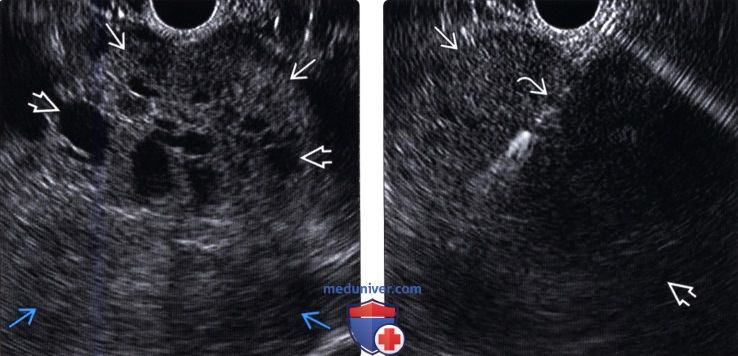
(Левый) У этой же пациентки при эндоскопическом УЗИ на соответствующих УЗ срезах определяется гетерогенное образование, состоящее из солидных зон, мелкокистозных анэхогенных участков и более крупного сложного кистозного компонента.
(Правый) При биопсии под контролем эндоскопического УЗИ видно, что игла введена в периферический мягкотканный нодулярый компонент крупного солидного и кистозного образования поджелудочной железы, которое оказалось солидной псевдопапиллярной опухолью.
3. КТ при солидной псевдопапиллярной опухоли:
• Гетерогенная плотность, смешанные солидные/кистозные зоны
• Контрастные капсула и мягкотканные выросты
• При КТ без контрастного усиления-участки кровоизлияний повышенной плотности; неконтрастируемые зоны некроза с низким коэффициентом ослабления
4. МРТ при солидной псевдопапиллярной опухоли:
• Четко отграниченное образование с центральной зоной гетерогенного яркого Т1 и Т2 сигнала:
о Низкая интенсивность сигнала при Т1 МРТ: капсула и солидные компоненты контрастируются в постконтрастную фазу приТ1 ВИ
о Высокая интенсивность сигнала при Т1 МРТ: внутриопухолевое кровоизлияние
о Высокая интенсивность сигнала при Т2 МРТ: некроз и кровоизлияние
о Низкая интенсивность сигнала при Т2 МРТ: толстая фиброзная капсула
5. Рекомендации по визуализации:
• Оптимальный метод визуализации:
о Мультипланарная КТ с контрастным усилением или МРТ
• Рекомендации по методике проведения исследования:
о Внутриопухолевые кровоизлияния лучше всего видны при КТ без контрастного усиления и МРТ
о Постконтрастные изображения должны также включать в себя томограммы артериальной фазы
в) Дифференциальная диагностика солидной псевдопапиллярной опухоли поджелудочной железы:
1. Муцинозная кистозная опухоль поджелудочной железы:
• Кровоизлияния отсутствуют; часто диагностируются у женщин средних лет
2. Неактивные нейроэндокринные опухоли:
• Кистозные компоненты обычно при Т1 МРТ не гиперинтенсивны; отмечается более выраженная гиперваскуляризация периферических отделов опухоли
3. Серозная цистаденома поджелудочной железы:
• Отсутствует крупный солидный компонент; обычно локализуется в головке поджелудочной железы; чаще встречается у пожилых женщин
4. Карцинома протока поджелудочной железы:
• Редко содержит некротический или геморрагический компоненты; как правило, наблюдается обструкция панкреатического или общего желчного протоков; пожилые пациенты

(Левый) При цветовой допплерографии на поперечном УЗ срезе определяется дольчатое кистозное образование, с центральной гиперэхогенной зоной. Обратите внимание на хорошо заметную прилегающую селезеночную вену.
(Правый) При КТ с контрастным усилением на соответствующей аксиальной томограмме определяется крупное дольчатое объемное образование пониженной плотности, содержащую кальцинаты в центральной части.
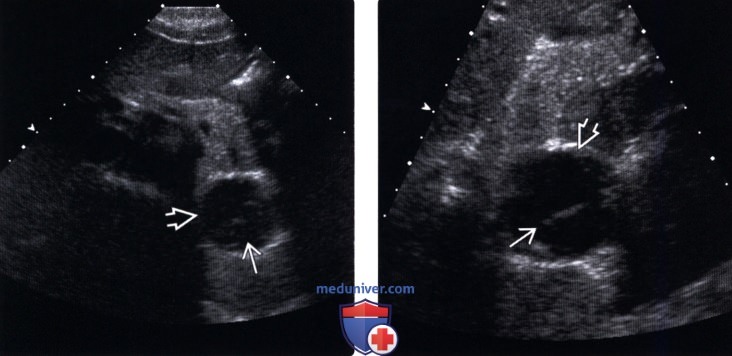
(Левый) При УЗИ брюшной полости в хвосте поджелудочной железы определяется четко отграниченное сложное кистозное образование, содержащее слоистый эхогенный материал.
(Правый) На увеличенном УЗИ-изображении той же области визуализируется четко отграниченное сложное кистозное образование поджелудочной железы, содержащее в центре эхогенный субстрат.
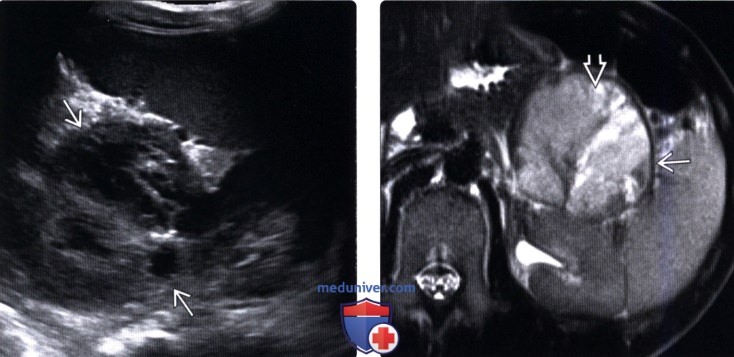
(Левый) На поперечном УЗ срезе брюшной полости в хвосте поджелудочной железы визуализируется сложное солидное и кистозное образование.
(Правый) При Т2 МРТ с подавлением жира на соответствующей аксиальной томограмме визуализируется крупное сложное кистозное образование, дающее гетерогенный гиперинтенсивный Т2-сигнал и Т2-темная толстая фиброзная капсула.
г) Патология:
1. Общая характеристика:
• Крупные солитарные опухоли, представляющие собой вариабельные комбинации солидного, геморрагического и некротического компонентов
• Низкий злокачественный потенциал
2. Макроскопические и хирургические особенности:
• Толстая фиброзная богато васкуляризованная капсула, окружающая мягкотканную опухоль; обычно не вызывает обструкции про-токов/эффекта объемного образования
3. Микроскопия:
• Солидные скопления гомогенных эпителиоидных клеток с участками дегенерации и зонами формирования псевдопапиллярных структур
д) Клинические особенности:
1. Проявления:
• Обычно протекает бессимптомно или вызывает неспецифические боли в животе
• Может определяться пальпируемое объемное образование брюшной полости
2. Демография:
• Около 90% женщины; возраст <35 лет
• Чернокожие американцы или пациенты не европеоидной расы
3. Течение и прогноз:
• Обычно доброкачественное, но имеется невысокий потенциал малигнизации
• Прогноз: после хирургической резекции — благоприятный; оперативное лечение обычно приводит к выздоровлению (пятилетняя выживаемость 95%)
• <10% метастазируют (обычно в печень) или рецидивируют
4. Лечение солидной псевдопапиллярной опухоли поджелудочной железы:
• Полное хирургическое иссечение
е) Диагностическая памятка. Советы по интерпретации изображений:
• Инкапсулированное объемное образование хвоста поджелудочной железы с солидным, кистозным и геморрагическим компонентом у молодых женщин не европеоидной расы
ж) Список использованной литературы:
1. Ganeshan DM et al: Solid pseudo-papillary tumors of the pancreas: current update. Abdom Imaging. 38(6): 1373-82, 2013
2. Reddy S et al: Surgical management of solid-pseudopapillary neoplasms of the pancreas (Franz or Hamoudi tumors): a large single-institutional series. J Am Coll Surg. 208(5):950-7; discussion 957-9, 2009
3. Choi JY et al: Solid pseudopapillary tumor of the pancreas: typical and atypical manifestations. AJR Am J Roentgenol. 187(2):W178-86, 2006
— Также рекомендуем «Рекомендации по методике УЗИ селезенки»
Редактор: Искандер Милевски. Дата публикации: 11.11.2019
Источник
Кабинет
Меню
Гистогенез солидно-псевдопапиллярной опухоли поджелудочной железы
Гены & Клетки: Том VIII, №2, 2013 год, стр.: 64-68
 
Авторы
Паклина О.В., Гордиенко Е.Н., Чекмарева И.А.
Солидно-псевдопапиллярная опухоль (СППО) – редкая опухоль поджелудочной железы (ПЖ) с неизвестным ги стогенезом, в связи с чем дискутируются несколько теорий её развития, включая генез из так называемых раковых стволовых клеток, которые могут являться дериватами эм бриональных зачатков яичников.
Исследовали 11 СППО ПЖ и 5 гранулезоклеточных опу холей яичников (ГКО) взрослого типа методом электрон ной микроскопии. При сравнительном ультраструктурном исследовании определялись сходные признаки как в ГКО, так и в СППО: наличие двух типов клеток, один из которых с характерными ядрами с глубокими инвагинациями нукле олеммы в виде продольных борозд, межклеточные контак ты в виде десмосом, в тканях определялось достаточно большое количество капилляров, находящихся в активном состоянии. Из всех опухолей яичника, развивающихся из клеток стромы полового тяжа, СППО наиболее близка к ГКО. Их роднит не только морфологическое сходство, но и биологический потенциал, клиническое течение и про гноз заболевания.
Проведенные исследования свидетельствуют в пользу теории эмбриональной миграции клеток зачатков яичников с их последующим вкладом в гистогенез солидно-псевдо папиллярной опухоли поджелудочной железы.
Солидно-псевдопапиллярная опухоль (СППО) – редкая опухоль поджелудочной железы (ПЖ). В ка честве отдельной гистологической формы впервые описана только в 1959 г. V.K. Frantz у трех больных[1]. A.B. Hamoudi c соавт. в 1970 г. дал подробное электронно-микроскопическое описание опухоли, а затем G. Klöppel c соавт. четко документировал пять клинических наблюдений в хирургической литературе в 1981 году[2]. В дальнейшем, по мере выявления и описания подобных новообразований, было пред ложено множество терминов для обозначения этих опухолей: опухоль Франтца (Frantz), опухоль Хамоди (Hamoudi), солидно-папиллярная опухоль, папилляр но-солидная опухоль, папиллярно-кистозная опухоль, солидно-кистозная опухоль, солидно-кистозно-папил лярная эпителиальная опухоль, солидно-кистозная ацинарно-клеточная опухоль, доброкачественная или злокачественная папиллярная опухоль поджелудоч ной железы, папиллярная эпителиальная опухоль поджелудочной железы у детей, аденокарцинома поджелудочной железы у детей[3–5].
СППО – это опухоль с низким потенциалом зло качественности, развивающаяся в 90-95% случаев у молодых женщин, гистологически представленная мономорфными полигональными плохо сцепленны ми между собой клетками, окружающими тонкостен ные кровеносные сосуды с образованием псевдопа пиллярных структур и участков солидного строения с частым развитием кистозно-геморрагических изме нений[6]. Гистогенез СППО поджелудочной железы до сих пор неизвестен. Ряд авторов предполагает ее развитие из стволовых клеток или клеток-пред шественниц протоковых или ацинарных структур поджелудочной железы[2, 7–10]. Так как эти опу холи обычно развиваются у молодых женщин, что связывают с действием женских половых гормонов и их рецепторами, исследователи предполагают раз витие СППО из эмбриональных зачатков яичников. Иммуногистохимическим методом (ИГХ) показана экспрессия опухолевыми клетками белка β-катенина, являющегося рецептором, участвующим в Wnt пути, а также мутация гена β-катенина, расположенного в 3 экзоне (CTNNB1), характерна не только для СППО, но и для гранулезоклеточной опухоли яичников (ГКО)[11–13].
Целью исследования явилась сравнительная уль траструктурная характеристика СППО и ГКО яичника взрослого типа.
Материал и методы
Исследовали 11 СППО ПЖ и 5 ГКО яичника взрослого типа. Гистологические препараты окра шивали гематоксилином и эозином. Для проведе ния электронно-микроскопического исследования из нефиксированного свежего операционного ма териала вырезали кусочки тканей размером при близительно 1 мм3 из разных мест опухоли, фик сировали в 2,5% растворе глутарового альдегида и 1% растворе четырехокиси осмия. Затем материал обезвоживали в спиртах возрастающей концентра ции (50, 70, 96 и 100%), после чего пропитыва ли в смеси окись пропилена-аралдитовая смола. Затем материал помещали в капсулы и заливали аралдитовой смолой, затем помещали в термостат при температуре 60°С на двое суток. Из получен ных блоков готовили полутонкие срезы толщиной 1,5–2 мкм. Срезы окрашивали толуидиновым си ним. Ультратонкие срезы толщиной 100-200 нм по лучали на ультрамикротоме фирмы LKB (Швеция). Ультраструктурное изучение препаратов проводили при помощи электронного микроскопа JEOL JEM 100-CX (Япония) в трансмиссионном режиме при ускоряющем напряжении 80 КВ.
Результаты
При сравнительном ультраструктурном исследо вании образцов тканей опухолей обращало на себя внимание наличие двух типов клеток как в ГКО, так и в СППО. Первый тип клеток с округлыми ядрами, в которых мелкодисперстный гетерохроматин был распределен равномерно по всей нуклеоплазме с конденсацией ближе к нуклеолемме и формирова нием в отдельных клетках выраженных ядрышек. В цитоплазме определялось умеренное количество митохондрий с частично разрушенными кристами, что можно отнести к дефектам фиксации, а также короткие профили гранулярной эндоплазматической сети (ЭПС) (рис. 1, 2). Второй тип клеток содержал ядра с глубокими инвагинациями нуклеолеммы в виде продольных борозд (на светооптическом уров не эти ядра имели специфический вид кофейных зе рен). В цитоплазме также присутствовали частично разрушенные митохондрии в большем количестве, чем в первом типе клеток, и короткие профили ЭПС. Глубокие инвагинаты, значительно увеличивающие поверхность ядерной мембраны, а также значитель ное количество митохондрий, свидетельствуют об интенсивных синтетических внутриклеточных про цессах в данной группе клеток (рис. 3, 4).
В ГКО и СППО межклеточных контакты были представлены мостиковидными и более плотными десмосомами (рис. 5, 6). В ткани встречались клет ки с темными ядрами с компактным крупноглыбча тым хроматином и темной цитоплазмой с разрушен ными органеллами, что можно отнести к начальным признакам внутриклеточной деструкции, как и при сутствие гранул липофусцина и наличие вторичных лизосом (рис. 7, 8).
Клетки с активными обменными процессами требуют достаточного поступления питательных ве ществ из кровеносной системы. В данном случае в тканях определялось достаточно большое коли чество капилляров, находящихся в активном состо янии. Об этом свидетельствовали множественные микроворсинки на люминальной поверхности эндо телиальных клеток и присутствие микропиноцитоз ных пузырьков в цитоплазме (рис. 9, 10).
На ультраструктурном уровне в СППО и грану лезоклеточной опухоли яичника обнаруживались и различия. В СППО определялись розеткоподобные комплексы клеток, окружающие расширенные ка пилляроподобные сосуды (рис. 11). В отдельных клетках гранулезы в цитоплазме определялся фи ламентоподобный материал и липидные вакуоли. Это можно объяснить присутствием в этих опухолях клеток теки, которым присущи липидные вакуоли. Также вокруг ряда клеток выявлялись фрагменты базальной мембраны (рис. 12). Хотя в литературе описаны элементы базальной мембраны в СППО, в своих исследованиях мы не обнаружили их.
Обсуждение
Вопросы гистогенеза СППО поджелудочной же лезы остаются спорными до настоящего времени. В свое время G. Zamboni с соавт. нашел превос ходное объяснение развитию опухолей ПЖ, чаще поражающих женщин[14]. Зачатки поджелудочной железы очень близки к половым зачаткам во время эмбриогенеза (на 5–6 нед. эмбрионального развития)[16].
Примитивные ткани яичников могут быть вклю чены в ткань поджелудочной железы в процессе слияния ее дорсального и вентрального зачатков, после чего эктопированные клетки-предшественни цы из тканей яичников могут получить импульс к прогрессивному развитию в ответ на женские гор моны в подростковом возрасте, что косвенно под тверждается экспрессией прогестерон-рецепторов опухолевыми клетками. Применительно к СППО эту теорию осветил D. Watanabe (2010)[16]. В ее под тверждение V. Deshpande с соавт. (2010) описал три случая подобных новообразований в яичниках со сходной с СППО морфологией и иммунопрофилем[18]. Редкие экстрапанкреатические случаи СППО (в сальнике, брыжейке толстой кишки, забрюшин но – позади головки ПЖ) также не противоречат те ории эмбриональной миграции[18, 19]. По данным литературы только в 10% случаев СППО встреча ются у мужчин[20, 21] и во всех этих случаях отмечалась экспрессия прогестерон-рецепторов. D. Watanabe (2010) объяснил этот факт синтезом прогестерона у мужчин надпочечниками и яичка ми, тем не менее, происхождение СППО у мужчин пока не ясно. Из всех опухолей яичника, разви вающихся из клеток стромы полового тяжа СППО наиболее близка к ГКО. Их роднит не только мор фологическое сходство, но и биологический потен циал, клиническое течение и прогноз заболевания. Основным методом лечения в обоих случаях является хирургическая резекция новообразования.
Таким образом, проведенные сравнительные ультраструктурные исследования солидно-псевдо папиллярной опухоли поджелудочной железы и гра нулезоклеточной опухоли яичников свидетельствуют в пользу теории эмбриональной миграции зароды шевых клеток яичников в поджелудочную железу на ранних этапах органогенеза.
Подняться вверх сайта
Источник
ЛАПАРОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У ДЕТЕЙ С
СОЛИДНОЙ ПСЕВДОПАПИЛЛЯРНОЙ ОПУХОЛЬЮ
Ю.Ю. Соколов, С.В. Стоногин, О.Я. Поварнин, В.А. Алейникова,
Е.В. Тимохович, А.Л. Леонидов, Л.П. Катасанова, Т.Р. Лаврова
Кафедра детской хирургии РМАПО,
Тушинская городская детская больница г. Москвы
Солидная псевдопапиллярная опухоль поджелудочной железы
относится к доброкачественным или низко злокачественным эпителиальным
новообразованиям, поражающим преимущественно девочек и женщин молодого возраста.
Впервые подобная опухоль была описана Frantz в 1959 году у 2-х летнего ребенка,
погибшего в ходе выполнения панкреатодуоденальной резекции. Частота
встречаемости данной опухоли составляет 0,2 – 2,7% от всех неэндокринных
опухолей поджелудочной железы. За последние 50 лет в литературе было
опубликовано около 450 наблюдений солидной псевдопапиллярной опухоли
поджелудочной железы, из них у 78 детей и подростков в возрасте до 16 лет.
Происхождение солидной псевдопапиллярной опухоли поджелудочной железы остается
неизвестным. Было высказано предположение о том, что данная опухоль развивается
из плюрипотентных эмбриональных стволовых клеток. В случаях радикальной резекции
прогноз благоприятный. К настоящему моменту в мировой литературе имеется
описание только 3-х клинических наблюдений лапароскопической резекции
поджелудочной железы у детей с солидной псевдопапиллярной опухолью.
В связи с низкой частотой встречаемости данной патологии описание единичных
клинических наблюдений могут представлять большой практический интерес для
детских хирургов. За последние 2 года нами по поводу солидной псевдопапиллярной
опухоли были выполнены две лапароскопические резекции поджелудочной железы.
Клиническое наблюдение 1. Больная Б., 14 лет, поступила в экстренном порядке с
болями в верхних отделах живота и рвотой. В лабораторных и биохимических
анализах отклонений от нормы не отмечено. При ультразвуковом исследовании и
компьютерной томографии в области перешейка ПЖ выявлен опухолевый узел размерами
65х55х50 мм с неровными контурами, тонкой капсулой и гипоэхогенными включениями.
С диагнозом «опухоль поджелудочной железы» больная была оперирована: выполнена
лапароскопическая сегментарная резекция поджелудочной железы с наложением
дистального панкреатогастроанастомоза (рисунок 1а, б).
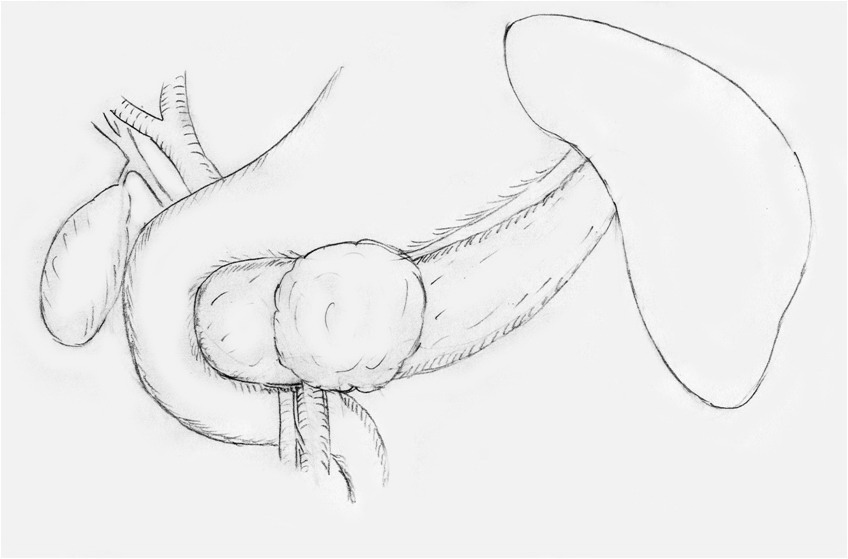
Рисунок 1 а.
Схема выявленной патологии: опухоль локализуется в области
перешейка поджелудочной железы
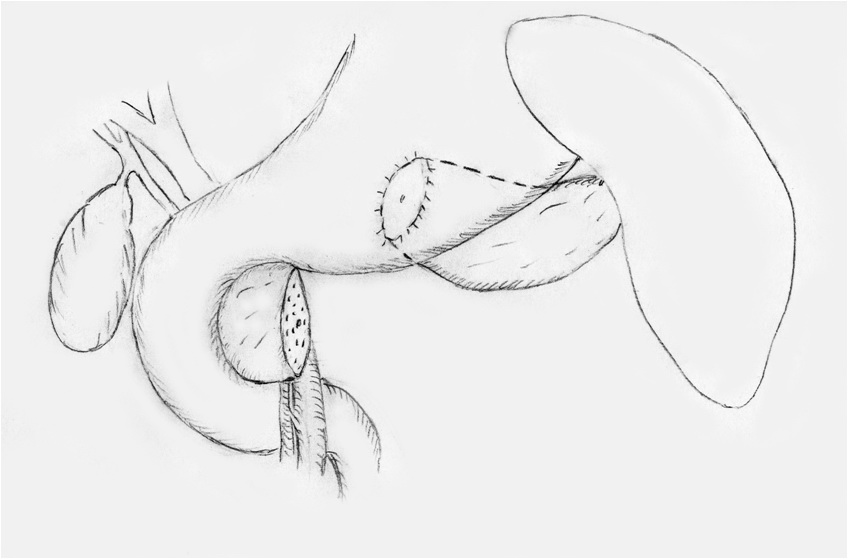
Рисунок 1 б.
Схема операции: секторальная резекция поджелудочной железы с
дистальным панкреатогастроанастомозом
После открытого введения через пупочное кольцо 10-мм троакара наложили
карбоксиперитонеум и ввели 10-мм оптику. Дополнительные 5-мм троакары установили
справа и слева от пупка, 3-мм троакар – в эпигастральной области. С помощью
электрокоагуляции широко рассекли желудочно-ободочную связку. Заднюю стенку
желудка фиксировали двумя тракционными швами, проведенными через переднюю
брюшную стенку. По нижнему и верхнему контуру поджелудочной железы на уровне
перешейка железы вскрыли задний листок брюшины. Тупым путем мобилизовали железу
по задней поверхности и создали туннель впереди верхней брыжеечной вены. На этом
уровне железу взяли на держалку и поперечно пересекли паренхиму с помощью моно-
и биполярной электрокоагуляции справа от опухоли (рисунок 2).
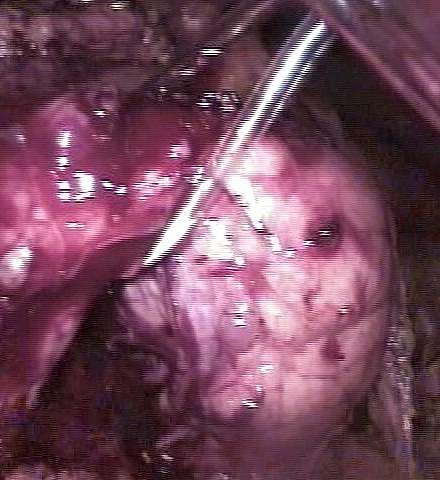
Рисунок 2.
При лапароскопии в перешейке поджелудочной железы выявляется
опухоль до 6см в диаметре.
Культю головки поджелудочной железы ушили обвивным интракорпоральным швом нитью
PDS 5-0. После этого мобилизовали тело поджелудочной железы и пересекли
паренхиму железы слева от опухоли. Вмешательство завершили наложением
двухрядного анастомоза между дистальной частью поджелудочной железы и задней
стенкой желудка. Для этого культю железы по окружности сшили обвивным швом нитью
викрил 4-0 с рассеченной задней стенкой желудка. Наружный ряд анастомоза
наложили отдельными узловыми швами нитью PDS 5-0, инвагинировав культю
поджелудочной железы в просвет желудка (рисунок 3).
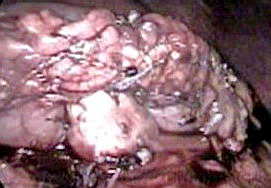
Рисунок 3.
Окончательный вид дистального панкреатогастроанастомоза.
Через правое троакарное отверстие в сальниковую сумку установили дренаж с
активной аспирацией. Резецированную опухоль поджелудочной железы погрузили в
целлофановый контейнер и удалили через расширенное до 2,5см околопупочное
троакарное отверстие. Длительность операции – 240 мин. При гистологическом
исследовании была установлена солидная псевдопапиллярная опухоль поджелудочной
железы с низкой вероятностью злокачественности.
Послеоперационный период протекал без осложнений. Энтеральный прием жидкой пищи
начали с 7 суток. Дренаж из сальниковой сумки удалили на 9 день. Выписана из
стационара на 15 сутки. Осмотрена через 1,5 года – рецидива опухоли нет.
Клиническое наблюдение 2. Больная С., 13 лет поступила в инфекционное отделение
Тушинской ГДБ в экстренном порядке с гастритической формой бактериальной
кишечной инфекцией неясной этиологии. При поступлении отмечалась рвота и
незначительные боли в животе. Пальпаторно в левом подреберье определялось
плотное опухолевидное образование с ровным краем. Лабораторные и биохимические
показатели были в норме. При ультразвуковом исследовании в верхних отделах
брюшной полости слева определялось объемное округлое образование 73х62х70мм с
капсулой, неоднородное с гипоэхогенными включениями. При спиральной компьютерной
томографии в верхних отделах брюшной полости между селезенкой, левой почкой и
желудком выявлено округлое образование до 6,5см в диаметре с капсулой, четкими
ровными контурами и единичными кальцификатами (рисунок 4).
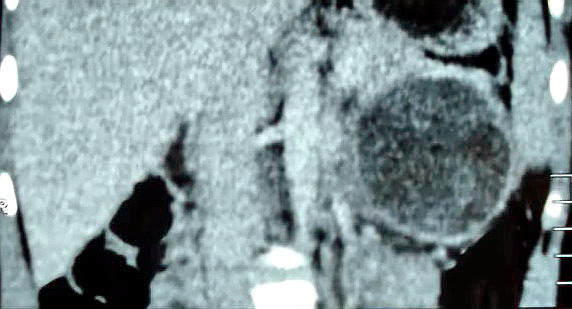
Рисунок 4.
Спиральная компьютерная томография: в проекции хвоста
поджелудочной железы выявляется кистозная опухоль с ровными контурами.
После внутривенного контрастирования 40 мл «визипаком 320» плотность капсулы
увеличилась незначительно, плотность содержимого кисты не изменилась. С
предположительным диагнозом «дермоидная киста» больная была оперирована:
выполнена лапароскопическая дистальная резекция поджелудочной железы с
сохранением селезенки.
Через пупочное кольцо ввели 10-мм троакара и оптику, наложили
карбоксиперитонеум. Дополнительные 5-мм троакары ввели справа и слева от пупка,
3-мм троакар – в эпигастральной области. В сальниковой сумке выявлено
опухолевидное образование до 6см в диаметре с плотной капсулой, которое интимно
связано с хвостом поджелудочной железы. После рассечения желудочно-ободочной
связки стенка опухоли прошита и фиксирована двумя тракционными швами,
проведенными через переднюю брюшную стенку. При последующей мобилизации
новообразования на одном из участков была вскрыта стенка кисты, выделился
тканевой детрит грязного цвета. С помощью моно- и биполярной коагуляции была
произведена резекция хвоста поджелудочной железы вместе с опухолью. При этом
сохранена целостность селезеночной артерии и вены, кровоснабжение селезенки не
нарушено. Культю поджелудочной железы ушили обвивным швом нитью PDS 5-0.
Сальниковую сумку через левое троакарное отверстие дренировали трубчатым
дренажом. Резецированную опухоль поджелудочной железы поместили в целлофановый
контейнер и удалили через расширенное до 3см околопупочное троакарное отверстие.
Длительность операции составила 180 мин.
При гистологическом исследовании солидные области чередуются с характерными
псевдопаппилярными структурами, имеются мелкие очаги некроза и периваскулярные
розетки (рисунок 5).
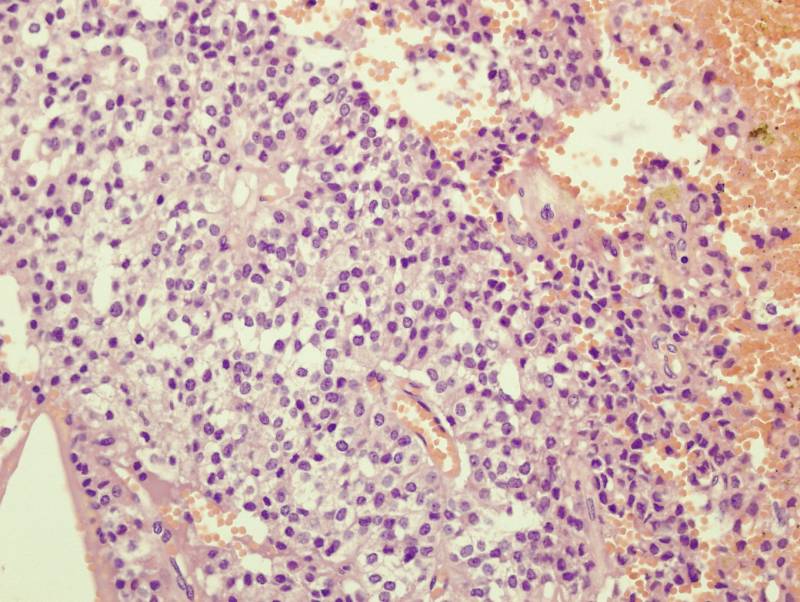
Рисунок 5.
При гистологическом исследовании резецированной опухоли
выявляются поля моноформных округлых или полигональных клеток среднего размера с
овальными ядрами и светлой цитоплазмой.
Заключение: «Солидная псевдопапиллярная опухоль поджелудочной железы».
Послеоперационный период протекал гладко. Прием жидкости через рот разрешили с 7
суток. Дренаж из брюшной полости был удален на 8 день. Выписана на 14 сутки.
Осмотрена через 4 месяца – данных за рецидив опухоли нет.
Цель данной демонстрации – показать возможность выполнения у детей с солидной
псевдопапиллярной опухолью лапароскопических резекций поджелудочной железы. При
локализации опухоли в перешейке железы секторальную резекцию поджелудочной
железы можно завершить наложением дистального панкреатогастроанастомоза. При
расположении опухоли в хвосте поджелудочной железы оптимальной является
лапароскопическая дистальная резекция поджелудочной железы с сохранением
селезенки.
Данные об авторах
| 1) Юрий Юрьевич Соколов – доктор медицинских наук, профессор, заведующий кафедрой детской хирургии Российской Медицинской Академии Последипломного Образования (РМАПО), e-mail: sokolov@permlink.ru | |
| 2) Сергей Васильевич Стоногин – хирург инфекционного корпуса Тушинской детской городской больницы, кандидат медицинских наук. e-mail: svas70@mail.ru | |
| 3) Олег Ярославович Поварнин – врач-хирург высшей категории, заведующий отделением плановой хирургии Тушинской детской городской больницы, хирург первой категории. 123480 Москва, Героев Панфиловцев 28, отделение плановой хирургии. | |
| 4) Валентина Александровна Алейникова – заместитель главного врача по хирургии Тушинской детской городской больницы, врач-хирург высшей категории. 123480 Москва, Героев Панфиловцев 28. | |
| 5) Евгений Васильевич Тимохович – врач-хирург отделения экстренной хирургии Тушинской детской городской больницы, 123480 Москва, Героев Панфиловцев 28, отделение экстренной хирургии. Тел 496-93-22. | |
| 6) Любовь Петровна Катасонова – заведующая отделением патологической анатомии Тушинской детской городской больницы, врач высшей категории. 123480 Москва, Героев Панфиловцев 28, отделение патологической анатомии. | |
| 7) Татьяна Романовна Лаврова – врач отделения лучевой диагностики Тушинской детской городской больницы, кандидат медицинских наук. 123480 Москва, Героев Панфиловцев 28, отделение лучевой диагностики. |
Источник

