Новое в лечении трижды негативного рака молочной железы
Британские онкологи нашли способ лечения самого агрессивного вида рака груди. Совместное использование химиотерапии и иммунотерапии снижает риск рецидива опухоли и повышает выживаемость. Хотя результаты пока предварительные, исследователи надеются, что такое лечение станет новым стандартом.
Совместное применение химиотерапии и иммунотерапии может значительно повысить шансы женщин на излечение от одного из самых опасных и агрессивных видов рака груди — трижды негативного рака. Своими выводами специалисты из Лондонского университета королевы Марии поделились на конгрессе Европейского общества медицинской онкологии в Барселоне.
Зачастую рак молочной железы можно подавить гормональной терапией. Опухолевые клетки обычно несут на себе рецепторы к гормонам прогестерону и эстрогену — оба гормона побуждают клетки делиться, что способствует развитию опухоли. Используя препараты, блокирующие действие гормонов, можно подавить рост опухоли.
Также можно задействовать рецептор HER2, взаимодействующий с эпидермальным фактором роста. Все факторы роста запускают деление клеток, в том числе и опухолевых. Для HER2 разработаны специальные препараты, останавливающие деление.
Однако в 12-20% случаев встречается тройной отрицательный рак молочной железы — у таких опухолей нет рецепторов ни к эстрогену, ни к прогестерону, ни к эпидермальному фактору роста.
Прогноз у трижды негативного рака куда хуже, а для лечения приходится применять менее точечные методики, чреватые осложнениями.
Чаще всего для лечения трижды негативного рака используется химиотерапия с последующим хирургическим вмешательством. Однако если все опухолевые ткани удалить не выходит, в 40-50% случаев опухоль снова возвращается в течение следующих трех лет.
С марта 2017 по сентябрь 2018 года в 124 городах 21 страны 1174 женщины с тройным отрицательным раком груди прошли через химиотерапию и операцию по удалению опухоли. 784 из них получали иммунотерапевтический препарат пембролизумаб до и после операции, а остальные — плацебо. Пембролизумаб рекомендован к применению также при меланоме и немелкоклеточном раке легкого.
Рецидивов не было у 64,8% женщин, получавших иммунотерапию. У тех, кто получал плацебо, частота рецидивов была на 13,6% выше.
Побочные эффекты во время лечения были связаны в основном с химиотерапией. Осложнения, которые можно было бы приписать иммунотерапии, встречались у 42% участниц из группы, получавшей пембролизумаб, и у 21% получавших плацебо. Серьезных проблем, угрожавших бы здоровью, исследователи не зарегистрировали.
Также исследователи отмечают возросшую выживаемость среди получавших иммунотерапию, но небольшая продолжительность исследования не позволяет делать выводы о дальнейших перспективах.
«Трижды негативный рак молочной железы — особенно агрессивная форма рака, отравляющая жизнь, — говорит ведущий автор исследования профессор Питер Шмид. — Мы искали лучшие варианты лечения. Эти ранние результаты свидетельствуют о том, что добавление иммунотерапии к химиотерапии приводит к значительному снижению рецидивов этой формы рака молочной железы».
Несмотря на то, что результаты пока предварительные, исследователи возлагают на них большие надежды.
«Если мы не допустим рецидива рака, мы вылечим больше пациентов, но нам нужны более долгосрочные данные, чтобы подтвердить это», — говорит Шмид.
Это лишь первый этап исследования. Ученые рассчитывают, что дальнейшая работа даст им больше оснований рекомендовать иммунотерапию как эффективный метод борьбы с трижды отрицательным раком. Если результаты подтвердятся, совмещение иммунотерапии с химиотерапией может стать новым стандартом лечения.
Ранее американские ученые предложили новый способ лечения рака груди. Они предложили использовать специально разработанный прибор, замораживающий раковые клетки с помощью углекислого газа. Эксперты рассказали, что уже успешно протестировали свою усовершенствованную технологию на животных.
Кроме того, новый способ лечения может стать спасением для большего количества людей, поскольку он не требует ни хирургического вмешательства, ни специальных палат, ни анестезий, ни лекарств. Изобретение американских специалистов способно убивать до 80% раковых клеток.
Видео дня. Как вор в законе и «сестра» Кадырова преследует любовника
Источник
14 января 2020 г.
Просмотров: 315
Рак молочной железы является наиболее часто встречающимся злокачественным заболеванием у женщин и, по данным мировой статистики, достигает 22,9%. Заболеваемость РМЖ неуклонно возрастает, несмотря на снижение смертности от него благодаря внедрению скрининга и эффективной системной химиотерапии [1,2,3].
Трижды негативный РМЖ (ТНРМЖ) составляет около 8–20% всех опухолей молочной железы; встречается чаще у женщин молодого возраста (до 50 лет) до наступления менопаузы, у женщин с ранним менархе, первой беременностью в более раннем возрасте, коротким периодом грудного вскармливания, повышенным индексом массы тела [4,5,6,7].
ТНРМЖ характеризуется отсутствием экспрессии РЭ, РП и HER-2, что существенно затрудняет лечение этого типа рака. Он представляет собой подтип опухолей с высоким риском прогрессирования заболевания, а также особым характером метастазирования, что приводит к раннему поражению внутренних органов и ЦНС. По результатам крупнейшего исследования, в которое были включены 12 858 больных ТНРМЖ, наиболее частой локализацией гематогенных метастазов оказались: головной мозг и легкие (соотношение вероятностей составило 5,32 и 2,27 соответственно), а метастатическое поражение костей оказалось в конце списка с отношением вероятностей — 0,23 [8,9,10,11].
Цель исследования
Анализ непосредственных и отдаленных результатов комплексного лечения больных ТНРМЖ.
Материалы и методы
В исследование было включено 128 больных с операбельным ТНРМЖ со сроком наблюдения 5 лет, находившихся на обследовании и лечении в ГБУЗ ОКД № 1 ДЗМ в период с 2006 по 2008 г. При составлении клинико-морфологической характеристики пациенток было выявлено, что медиана возраста больных составила 57 лет (от 31 года до 83 лет).
По данным гистологического исследования, у пациенток преимущественно встречался инфильтративный протоковый рак — 107 (83,6%).
Инфильтративный дольковый рак был верифицирован — у 14 (10,9%) больных, а инфильтративный дольково-протоковый — у 7 (5,5%) пациенток.
В подавляющем количестве случаев у больных была 3 степень злокачественности опухоли — 69 (53,9%) пациенток. 2 степень злокачественности опухоли — у 56 (43,8%) больных, а 1 степень — у 3 (2,3%) пациенток.
Большинство пациентов, по данным иммуногистохимического исследования, имели высокий индекс пролиферативной активности (Ki-67 > 19%) — 119 (93%). В 9 случаях (7%) индекс пролиферативной активности был меньше 19. Таким образом, пациентки, включенные в исследование, характеризовались совокупностью неблагоприятных признаков: в 93% случаев опухоли характеризовались высоким индексом пролиферативной активности и в 97,7% случаев — 2–3 степенью злокачественности (рис. 1).
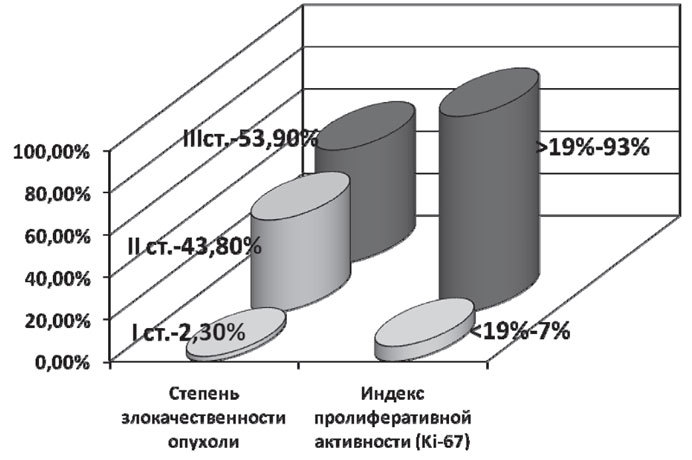 Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
На хирургическом этапе комплексного лечения пациенток с ТНРМЖ были выполнены четыре вида оперативных вмешательств: радикальная резекция молочной железы, радикальная мастэктомия по Мадден, радикальная мастэктомия по Пейти, радикальная мастэктомия по Холстеду.
В 97 случаях (75,8%) из 128 хирургическое лечение было проведено на первом этапе комплексного лечения. Распределение по стадиям этих пациенток представлено на рисунке 2.
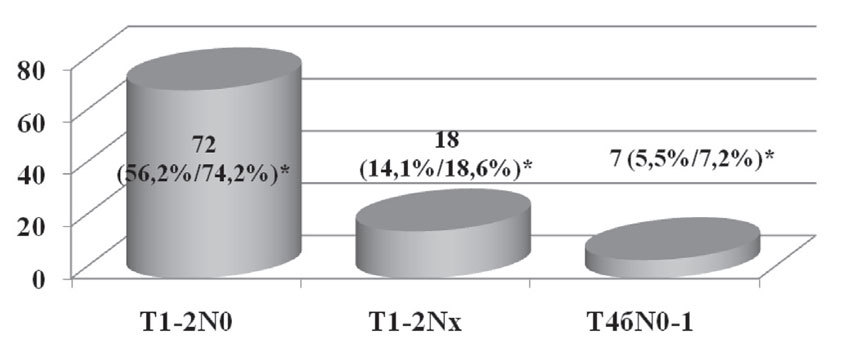 Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
* % от общего числа пациенток / % от числа пациенток, которым проводилось хирургическое лечение не первом этапе
Неоадъювантная химиотерапия как составляющая комплексного лечения была проведена 31 пациентке (24,2%) по следующим показаниям: наличие верифицированных метастазов в регионарные (подмышечные и/или подключичные) лимфоузлы и/или инфильтративно-отечная форма рака молочной железы (рис. 3).
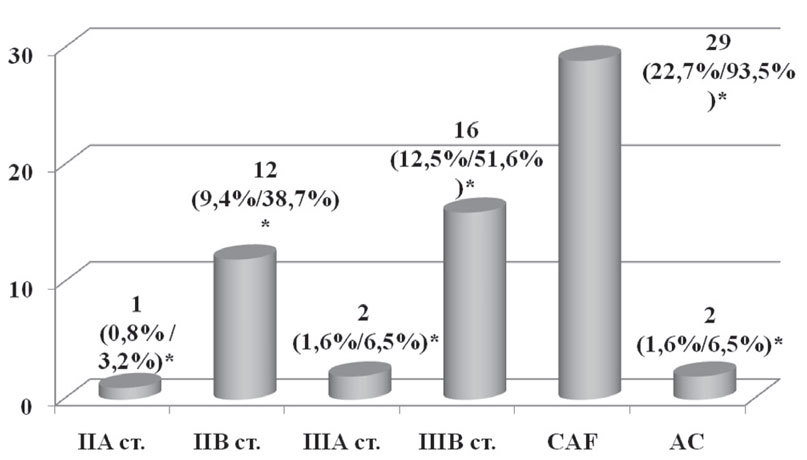 Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
*— % от общего числа пациенток / % от числа пациенток, которым проводилась неоадъювантная химиотерапия
Для проведения неоадъювантной химиотерапии применялись две схемы химиотерапии:
- 1-я схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 5-фторурацил 600 мг/м2) была применена 29 пациенткам, из них в 28 случаях было проведено 2 курса и 1–3 курса химиотерапии;
- 2-я схема — AC (доксорубицин 50 мг/м2 + циклофосфан 600 мг/м2) была назначена 2 пациенткам, которым было проведено 4 курса химиотерапии.
Адъювантная химиотерапия была проведена 70 (54,7%) пациенткам при различных стадиях заболевания (рис. 4). Применялись 4 схемы адъювантной химиотерапии:
- 1-я схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 5-фторурацил 600 мг/м2), была проведена 46 пациенткам (65,8%), из них 38 больным (54,3%) было выполнено 4 курса и 8 (11,5%) — 6 курсов химиотерапии;
- 2 схема — AC (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2), была назначена 16 пациенткам (22,8%), из них 11 (15,7%) — 4 курса и 5 (7,1%) — 6 курсов химиотерапии;
- 3-я схема — 5-фторурацил 600 мг/м2 + доксорубицин 50 мг/м2, была применена 5 пациенткам (7,1%), в количестве 4 курсов химиотерапии;
- 4-я схема — абитаксел 175 мг/м2 + доксорубицин 50 мг/м2, была проведена 3 пациенткам (4,3%), в количестве 4 курсов химиотерапии.
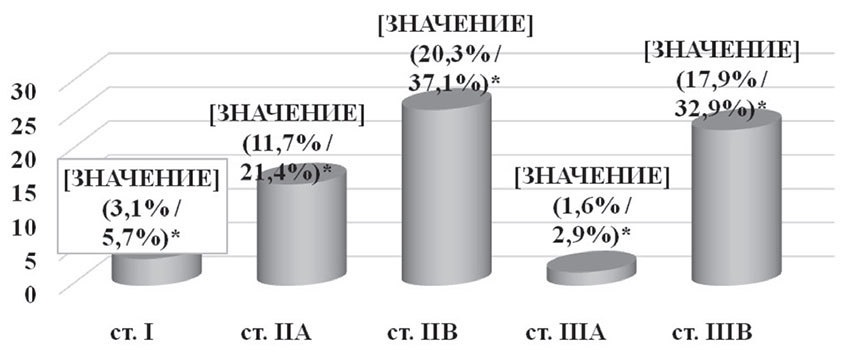 Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
*— % от общего числа пациенток / % от числа пациенток, которым проводилась адъювантная химиотерапия
Лучевая терапия как составляющая комплексного лечения пациенток с ТНРМЖ проводилась как в предоперационном, так и в послеоперационном периоде.
Основными показаниями к назначению лучевой терапии являлись: возможность выполнения органосохраняющего хирургического лечения (радикальная резекция молочной железы); наличие метастазов в 4 и более регионарных (подмышечных и/или подключичных) лимфоузлах, не спаянных между собой; наличие метастатического конгломерата лимфоузлов до начала лечения; инфильтративно-отечная форма РМЖ.
Предоперационная лучевая терапия была проведена 2 пациенткам (1,6% от общего числа).
Одной больной (0,8% от общего числа) с РМЖ стадии II В. — T2N1M0 с целью уменьшения размеров первичной опухоли в суммарной очаговой дозе (СОД) — 20 Гр.
Другой пациентке (0,8% от общего числа) — при РМЖ стадии IIIБ — T4бN2M0 с целью уменьшения отека молочной железы, т. к. по результатам проведения неоадъювантной химиотерапии была выявлена стабилизация, в СОД — 25 Гр.
Послеоперационная лучевая терапия была проведена 39 пациенткам (30,5%).
Результаты исследования
Проведение комплексного лечения пациенток с ТНРМЖ обусловило необходимость оценки его непосредственных и отдаленных результатов.
При проведении хирургического этапа лечения пациенток с ТНРМЖ нами в послеоперационном периоде был отмечен ряд осложнений, которые были обусловлены прежде всего объемом выполненных оперативных вмешательств. В основном у пациенток были зафиксированы случаи развития лимфостаза верхней конечности — 35 случаев (27,3%); длительной лимфорреи — 18 случаев (14,1%); краевого некроза лоскута (после радикальной мастэктомии), в результате которого заживление послеоперационный раны происходило частично за счет вторичного натяжения — 2 случая (1,6%) (рис. 5).
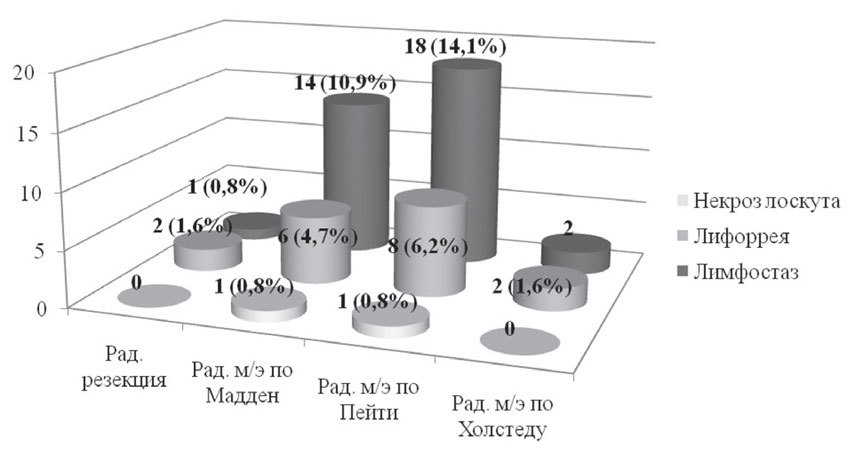
Рис. 5. Характер ранних послеоперационных осложнений в зависимости от вида хирургического вмешательства
Оценка эффективности неоадъювантной химиотерапии проводилась на основании результатов контрольного обследования (маммография и УЗИ молочных желез, подмышечных, над- и подключичных лимфоузлов) и данных о степени лечебного патоморфоза в опухоли, полученных в результате гистологического исследования операционного материала.
У 11 пациенток (35,5%) на фоне проведенной химиотерапии был достигнут полный регресс опухоли (лечебный патоморфоз 4-й степени); у 10 (32,2%) — частичная регрессия (патоморфоз 3-й степени); у 6 (19,4%) — стабилизация (патоморфоз 2-й степени); у 4 пациенток (12,9%) отмечено прогрессирование заболевания (патоморфоз 1-й степени) (рис. 6).
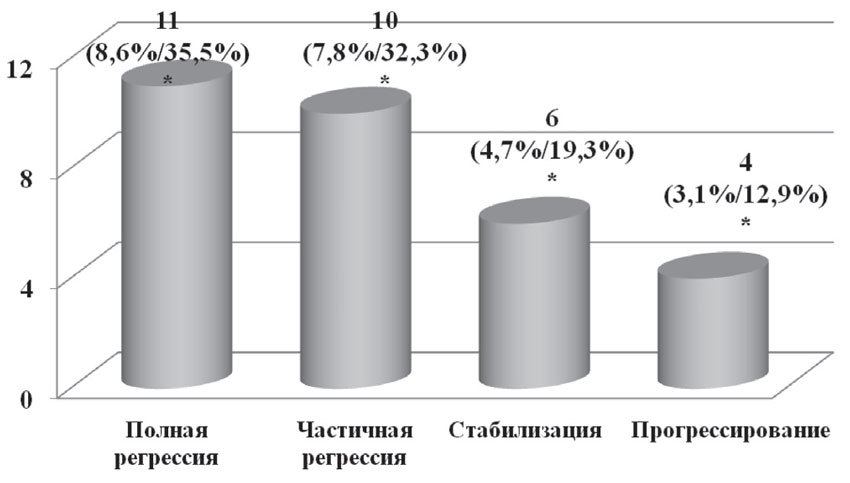 Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
*— % от общего числа пациенток/% от числа пациенток, у которых была выявлена данная степень лечебного патоморфоза опухоли при данной степени заболевания
Помимо оценки эффективности неоадъювантной химиотерапии были проанализированы ее побочные эффекты, которые отмечались у всех (100%) пациенток. Основными проявлениями токсичности были гематологическая токсичность (лейкопения и тромбоцитопения), тошнота, рвота, стоматит, ладонно-подошвенный синдром и др. Вышеуказанные побочные эффекты требовали коррегирующей симптоматической терапии, но не привели к отсрочке или отмене лечения (рис. 7).
Аналогичные результаты были получены и при оценке токсичности вышеуказанных схем адъювантной химиотерапии (рис. 7).
В двух случаях проведения предоперационной лучевой терапии был получен хороший лечебный эффект в виде частичной регрессии опухоли. Одной больной была проведена дистанционная гамматерапия в суммарной очаговой дозе 20 Гр по поводу РМЖ IIб ст., второй 25 Гр — IIIб ст.
У 39 пациенток (30,5%) на фоне проведения послеоперационной лучевой терапии отмечались следующие побочные реакции: повреждения кожи I степени были зарегистрированы у 14 больных (11,0%); II–III cтепени — у 3 (2,4%); лучевые повреждения подкожной клетчатки I cтепени — у 34 пациенток (26,6%), а II–III степени — у 5 (4%).
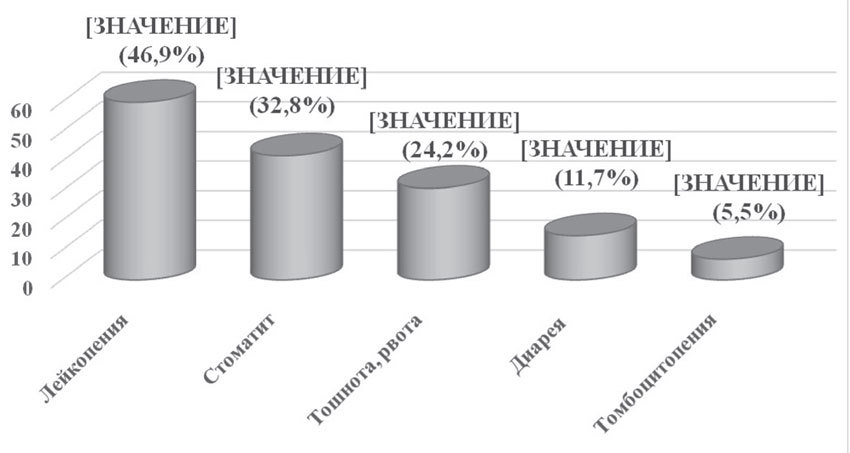 Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
С целью оценки отдаленных результатов комплексного лечения пациенток с ТНРМЖ у 128 больных были прослежены сроки появления местных рецидивов и гематогенных метастазов в течение 5–6 лет, а также их локализация. Помимо этого была проведена оценка сроков безрецидивной и общей 5-летней выживаемости (рис. 8). Все полученные данные были обработаны в программе IBM SPSS Statistics, а также при помощи расчетов по методу Каплана-Мейера, что и позволило проанализировать результаты комплексного лечения пациенток с ТНРМЖ.
Из 128 пациенток у 3 (2,3%) на втором году наблюдения был выявлен локальный рецидив, медиана их появления составила 15 месяцев и 7 дней. Этим больным было проведено комплексное лечение по поводу РМЖ IIIб стадии.
 Рис. 8. Отдаленные результаты комплексного лечения
Рис. 8. Отдаленные результаты комплексного лечения
В результате наблюдения в течение 5 лет у 31 пациентки (24,2%) были диагностированы гематогенные метастазы. Следует отметить, что большая их часть была выявлена на 2–3 годах наблюдения, в среднем — через 23 месяца и 6 дней от начала лечения. Локализация гематогенных метастазов была достаточно разнообразной: в 9 случаях (7,03%) гематогенные метастазы были диагностированы в костях, в 5 случаях (3,91%) — в легких, в 5 случаях (3,91%) — в надключичных лимфоузлах, в 4 случаях (3,13%) — в печени, в 3 случаях (2,34%) — в плевре, по одному случаю (0,78%) — в коже и головном мозге. У 3 пациенток (2,34%) были выявлены сочетанные метастазы: в головной мозг и кости, легкие и кости, кожу и плевру (рис. 9).
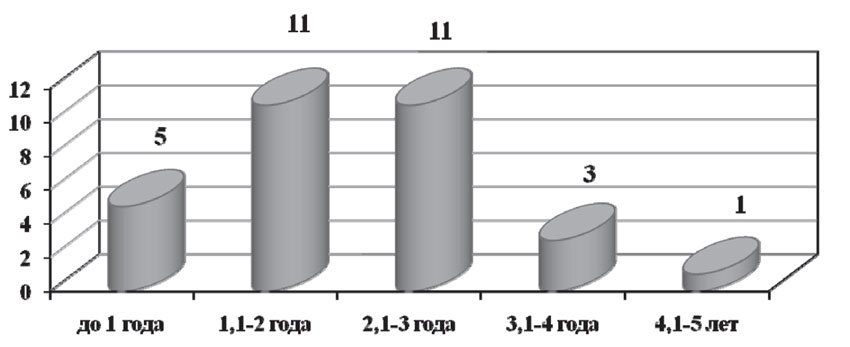 Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Пятилетняя безрецидивная выживаемость у пациенток, получавших комплексное лечение по поводу ТНРМЖ, составила 75,8%: при I стадии — 28 больных (84,9%), при IIа — 34 пациентки (80,9%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%) (рис. 10).
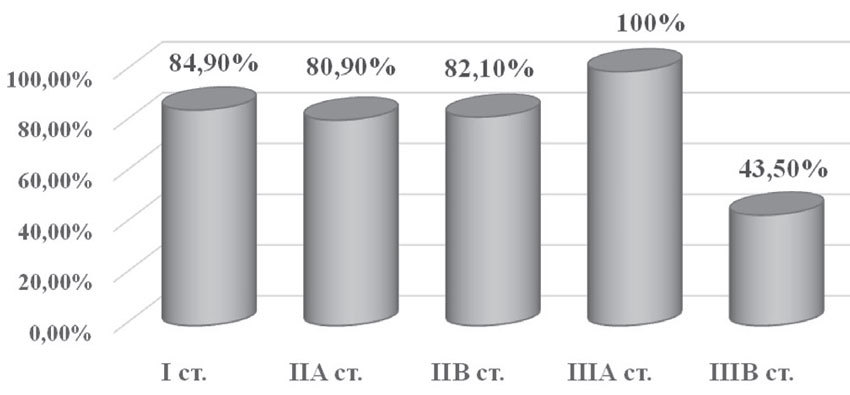
Рис. 10. Пятилетняя безрецидивная выживаемость в зависимости от стадии заболевания
Общая пятилетняя выживаемость составила 77,3%: при I стадии — 28 больных (84,9%), при IIа — 36 пациенток (90,5%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%). Смерть на первом году наблюдения была зафиксирована у 1 больной (0,8%) (рис. 11).
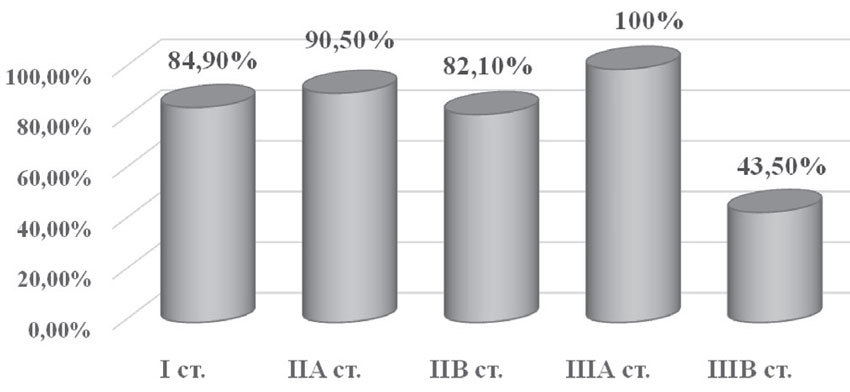 Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Заключение
Полученные результаты свидетельствуют о высокой степени эффективности примененных нами способов диагностики и схем комплексного лечения больных с операбельной формой ТНРМЖ.
Литература:
- Химиотерапия при метастатическом раке молочной железы. Маммология. Хирургия молочной железы [Электронный ресурс]. Режим доступа: https://mammalogy.eurodoctor.ru/chemotherapybreastcancer.
- Parkin D. M. Black-white differences in cancer risk in Harare, Zimbabwe, during 1991–2010. /D. M. Parkin, E. Chokunonga, P. Windridge et al.// Int. J. Cancer. — 2016. — № 138(6). — P.1416–1421.
- Audeh W. Novel treatment strategies in triple-negative breast cancer: specific role of poly (adenosine diphosphate-ribose) polymerase inhibition. /W. Audeh// Pharmgenomics Pers. Med. — 2014. — № 7. — P.307–316.
- Bauer K.R., Brown M., Cress R.D., Parise C.A., Caggiano v. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-calledtriple-negative phenotype: a population-based study from the California cancer Registry. // Cancer. — 2007. — № 9. — р.1721–1728.
- Carey L. A. De-escalating and escalating systemic therapy in triple negativebreast cancer. /L. A. Carey// Breast. — 2017. — № 34(1) — P.112–115.
- Carey L. A. Race, response to chemotherapy, and outcome within clinical breast cancer subtypes. /L. A. Carey, J. R. Tichy, A. M. Deal, C. K. Anders, K. Reeder-Hayes// Breast Cancer Res. Treat. — 2015. — № 150(3). — P.667–74.
- Livasy C. A. Dysregulation of the epigenome in triple-negative breast cancers: basal-like and claudin-low breast cancers express aberrant DNA hypermethylation. /C. A. Livasy, J. D. Roll, A. G. Rivenbark et al.// Exp. Mol. Pathol. — 2013. — № 95(3). — P.276–287.
- Mehta R. S. Clinical outcome of triple-negative breast cancer with BRCA mutation in the context of dose-dense and or metronomic chemotherapy. /R. S. Mehta, C. Liu// ASCO Annual Meet. — 2011. — P.1109.
- Rakha E. A. Novelimmunohistochemistry-based signatures to predict metastatic site of triple-negative breast cancers. / E. A. Rakha, S. Klimov, P. C. Rida et al.// Br. J. Cancer. — 2017. — № 117(6). — P.826–834.
- Поддубная И.В., Карселадзе А.И., Кулевич Е. Е. Морфология тройного негативного рака молочной железы // Архив патологии, 2010. — Т. 72, № 2. С. 8–12.
- Поддубная И. В. Клиническая характеристика тройного негативного рака молочной железы // Вестник РОНЦ им. Н. Н. Блохина РАМН. — 2010. — Т. 22, № 1. С. 71–76.
Оригинал опубликован по ссылке
Источник
Агрессивный и рано метастазирующий подтип. Трижды негативный рак молочной железы относится к худшему варианту опухолевого роста: чаще возникает у молодых женщин, нет мишеней для лечения, прогноз неблагоприятный.
Трижды негативный рак молочной железы
Все иммуногистохимические реакции отрицательны. Трижды негативный рак молочной железы (ТНРМЖ) выявляется у 20-24% пациенток. Этот подтип опухоли характеризуется:
· Отсутствием в железистой ткани груди рецепторов к женским гормонам (эстрогенам и гестагенам);
· Негатив HER2;
· Высокая пролиферативная активность.
Кроме этих стандартных показателей, для тройного негативного РМЖ характерны другие отрицательные параметры, формирующие крайне неблагоприятный вариант опухолевого роста. Лечить можно и нужно, но важно понимать – отсутствие мишеней для прицельной терапии снижает эффективность стандартных методов лечения.
Особенности опухолевого роста
Биологический подтип карциномы с неблагоприятным прогнозом. Трижды негативный рак молочной железы имеет следующие особенности:
· Чаще обнаруживается у молодых женщин в возрасте от 35 до 59 лет (в среднем 40-55 лет);
· Наличие в прошлом беременностей, родов и длительной лактации никак не влияет на снижение риска рака груди;
· Большой размер первичного злокачественного очага;
· Преобладание инвазивных протоковых гистологических типов карцином;
· У большей части пациенток обнаруживается 3 степень злокачественности (около 70%);
· Отсутствие некротических процессов внутри опухоли;
· Высокая частота выявления мутации генов BRCA (наследственные варианты опухоли);
· Повышенная агрессивность карциномы, выявляемая при определении индекса пролиферации Ki-67;
· Высокая вероятность возникновения синхронного и метахронного рака в молочных железах (сразу в обеих железах или последовательное возникновение злокачественных узлов);
· Ранее начало метастазирования;
· Реальный риск рецидива опухоли;
· Низкая выживаемость пациенток.
Кажется, что негатив во всем – от молекулярных характеристик до прогноза. И так оно и есть, но при этом у части пациенток возникает хороший ответ на химиотерапевтические и таргетные препараты.
Лечение ТНРМЖ
Порой с 3-4 стадией карциномы в груди пациентка успешно излечивается и живет долгие годы без рецидива, но бывают ситуации, когда уже при 1-2 стадии болезнь развивается столь стремительно, что в течение года все заканчивается. Трижды негативный рак молочной железы – это именно тот фактор, который во многом определяет дальнейшее неблагоприятное развитие событий.
Да, прогноз плохой, но это не повод для того, чтобы обреченно «опускать руки» и «сдаваться на милость врагу». ТНРМЖ имеет массу подтипов и молекулярных особенностей – необходимо воспользоваться каждой возможностью для лечения. В частности, при наличии у пациентки мутаций генов BRCA можно и нужно использовать имеющиеся препараты платины в сочетании с новыми лекарствами из группы ингибиторов PARP (влияние на раковые клетки через ДНК), которые показали хороший лечебный эффект. Значимое подспорье в терапии могут дать лекарственные средства, подавляющие возникновение новых сосудов в опухолевой ткани (антиангиогенный эффект).
Пока трижды негативный рак молочной железы относится к неблагоприятным подвидам злокачественной опухоли в груди, что связано с быстрым ростом опухоли, ранним формированием метастазов и отсутствием эффекта к стандартным схемам химиотерапии. Но – молекулярные и иммуногистохимические исследования ведутся, поиск комбинаций лекарств продолжается, новые препараты апробируются и внедряются в клиническую практику.
Статья опубликована на сайте parashistay.ru
Источник


