Лечения гормонорезистентного рак предстательной железы
Гормонорезистентный рак простаты — первичная опухоль, изначально не зависящая от уровня андрогенов, или прогрессирование заболевания на фоне достигнутого посткастрационного уровня тестостерона. Симптомы отсутствуют либо связаны с локализацией метастатических очагов и ростом новообразования. Типично усиление болевого синдрома и интоксикация. Диагностика подразумевает определение уровня ПСА, ТРУЗИ, МРТ (КТ) висцеральных органов, легких и малого таза, ПЭТ, сцинтиграфию костей скелета. Тактика может включать изменение схем гормонотерапии, назначение блокаторов выработки андрогенов надпочечников, иммунотерапию, моно- и полихимиотерапию, радионуклидную терапию.
Общие сведения
Гормонорезистентный рак простаты (гормонорефрактерный, гормононечувствительный, андроген-рефрактерный, устойчивый к кастрации РПЖ, «болезнь ускользнувших гормонов») представляет собой злокачественную, изначально гормоночувствительную опухоль, которая прогрессирует через 12-24 месяца после биорхиэктомии и гормонотерапии антиандрогенами, либо новообразование с первичной резистентностью (15-30% случаев). Четких критериев разделения между вторичной и первичной гормоноустойчивостью в онкологии нет, за основу берутся клинические признаки. Увеличение количества случаев гормонорезистентного рака простаты связано с доступностью улучшенных способов визуализации — магнитно-резонансного сканирования и позитронно-эмиссионной томографии.
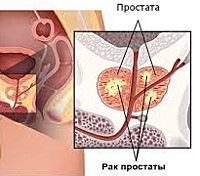
Гормонорезистентный рак простаты
Причины гормонорезистентного рака простаты
Причины развития опухолевого процесса в предстательной железе остаются неясными, заболевание относят к мультифакторным. Предполагается связь между развитием опухоли и особенностями питания (преобладание красного мяса и жирной пищи), вредными привычками, контактами с канцерогенами, неблагоприятными экологическими факторами (инсоляция, облучение), хроническим простатитом с частыми рецидивами, ИППП (ретровирусная, цитомегаловирусная инфекция, генитальный герпес), иммуносупрессией, вызванной любой причиной, генетическими факторами и предраковой патологией. Относительно причин, вызывающих гормонорезистентность РПЖ, выдвинуто несколько гипотез:
- Теория клонального доминирования. Опухолевая ткань по своей морфологии на 60% гетерогенна, т. е. представлена различными клетками: гормонозависимыми и гормононезависимыми. Под воздействием антиандрогенной терапии последние начинают доминировать.
- Теория стволовых клеток. Доказано, что стволовые клетки способствуют обновлению тканей. Длительно существующее состояние с посткастрационным уровнем тестостерона дает начало поколению новых клеток, свободных от влияния гормонов.
- Адаптивная теория. Адаптационные механизмы помогают клеткам приспособиться к сверхнизким уровням гормонов. Развившиеся в условиях гормонального дефицита, они начинают агрессивно делиться, приобретая рефрактерность к андрогенам.
Патогенез
В патогенезе заболевания прослеживаются молекулярные механизмы. В раковых клетках присутствуют нарушения экспрессии генов, контролирующих процессы пролиферации. Увеличение факторов роста и их рецепторов, активация сигнальных каскадов, связанных с андроген- и эстроген-чувствительными рецепторами, повышение активности эмбриональных сигнальных путей способствует появлению агрессивных свойств в уже видоизмененных клетках, в результате чего начинается их рост, миграция и метастатическая активность. Нарушение экспрессии генов и белков проявляется срывом контроля над апоптозом, из-за чего раковые клетки обретают устойчивость к химиотерапии. Роль эпигенетических факторов, генетических мутаций и сигнальных белков, ответственных за питание опухоли, рост и кровоснабжение, не изучена до конца.
Для развития гормонорезистентной опухоли важно соотношение между андрогенами и андрогенными рецепторами. Даже при терапии антиандрогенами и проведении билатеральной орхиэктомии надпочечники, ткани простаты и сама опухоль за счет усиленной экспрессии цитохрома P450С17 (CYP17) продолжают выработку андрогенов, которых достаточно для активации андрогеновых рецепторов в условиях низкой концентрации тестостерона.
Симптомы гормонорезистентного рака простаты
При гормонорефрактерном РПЖ клинические проявления отсутствуют либо представлены местными симптомами. Задержка мочи регистрируется у 20-25% мужчин, боль в спине и ногах ‒ у 20-40%, гематурия ‒ у 10%. Гемоспермия свидетельствует о вовлеченности в процесс семенных пузырьков. У пациентов с симптоматическим течением наиболее часты жалобы на учащение мочеиспускания (38%), ослабление струи мочи (23%), ургентные позывы (10%). Слабость, повышение температуры в вечерние часы, потливость служат общими проявлениями интоксикации. Для гормонорезистентной опухоли характерно постепенное нарастание клинических проявлений, что связано с ее прогрессированием. Из-за иммуносупрессии повышается восприимчивость к инфекциям.
Метастатические симптомы включают потерю веса и плохой аппетит, боль и ломоту в костях, образование патологических переломов, дискомфорт в нижних конечностях и отечность на фоне непроходимости венозных и лимфатических притоков при метастазах. При сдавлении опухолью или забрюшинными лимфоузлами области мочеточника и его обструкции появляются тошнота, боли в пояснице на стороне поражения, температурная реакция с ознобом, что характерно для присоединения острого пиелонефрита.
Осложнения
Урологические осложнения рака простаты могут проявиться развитием острого воспалительного процесса в мочеполовом тракте, кровотечением на фоне прорастания сосуда опухолью. При обструкции мочевыводящих путей на фоне роста новообразования часто диагностируют рефлюксы и гидронефроз, что может привести к нарушению функций почек. При назначении химиопрепаратов нередко развивается нефропатия с исходом в хроническую почечную недостаточность. Негативные последствия лечения рака предстательной железы проявляются в виде стойкой эректильной дисфункции, чему способствуют терапия андрогенной депривации (биорхиэктомия + гормонотерапия) и простатэктомия. При повреждении сфинктеров и нарушении иннервации мочевого пузыря из-за травматизации во время операции может присоединиться недержание мочи. Патологические переломы и компрессия спинного мозга — осложнения метастатического рака простаты.
Диагностика
Как правило, диагноз рака простаты уже подтвержден, пациент получает либо получил лечение, направленное на максимально возможное уменьшение выработки андрогенов. Онкологические больные с данной нозологией в обязательном порядке наблюдаются у онколога или онкоуролога, регулярно проходят необходимые исследования. Первичную гормонорезистентностиь опухоли можно предположить на основании гистологического типа (базально-клеточные, переходно-клеточные, анапластические, плоскоклеточные раки), при отсутствии ответа на антиандрогенную терапию в течение 3 месяцев, росте ПСА или при появлении новых симптомов, несмотря на прием препаратов. Общие принципы диагностики включают:
- Определения уровня ПСА и тестостерона. О биохимическом прогрессе опухолевого процесса можно вести речь, если зафиксировано последовательное увеличение уровня простатспецифического антигена (на 50% выше от минимально достигнутого) в трех анализах, при обязательном уровне тестостерона менее 50нг/дл (1,7 нмоль/л). Промежуток времени между тестами — не менее недели.
- Общий анализ крови. В результатах общего анализа крови выявляют ускорение скорости оседания эритроцитов, лейкоцитоз, анемию, что может свидетельствовать о прорастании опухоли в мочевой пузырь. Снижение гемоглобина ниже 115-120г/л и одновременный рост ПСА выше 100 нг/мл — неблагоприятный прогностический признак.
- Определение уровня ЛДГ и ЩФ. Повышение уровня лактатдегидрогеназы позволяет предположить висцеральное метастазирование. Избыток щелочной фосфатазы — признак метастатического поражения костной ткани, выявляется у 70% пациентов с генерализацией опухолевого процесса.
- ТРУЗИ и МРТ простаты. Трансректальное ультразвуковое исследование предстательной железы при гормонорезистентном раке может показать увеличение объема железы и инвазию опухоли в соседние органы. Более точную картину дает МРТ органов малого таза, которая не только демонстрирует отношение опухоли с близлежащими структурами, но и в 50-70% позволяет оценить состояние внутритазовых лимфоузлов.
- Инструментальные методы визуализации. Для поиска метастазов исследуют органы грудной клетки с помощью КТ или рентгенографии, проводят ультразвуковое сканирование, МРТ или КТ органов брюшной полости. Радиоизотопную сцинтиграфию назначают при подозрении на метастазы в кости скелета или для отслеживания динамики процесса. ПЭТ—КТ может быть выполнена пациенту с раком простаты после лечения, если метастатические очаги не определяют, а уровень ПСА продолжает расти.
Лечение гормонорезистентного рака простаты
Гормонорефрактерный рак остается одним из самых сложных диагнозов в урологии, сопровождается высокой смертностью, однако существует множество аспектов в лечении, которые позволяют увеличить продолжительность жизни и улучшить ее качество. В течение последнего десятилетия введено несколько новых методов терапии с доказанной безопасностью и эффективностью. Одобрено применение новых лекарств, которые подавляют синтез тестостерона с помощью иных механизмов действия, отличных от предшественников — антагонистов андрогеновых рецепторов 1 поколения (флутамид, бикалутамилд, нилутамид). Внедрены схемы лечения, включающие кетоконазол, эстрогены, эстрамустина фосфат, ЛГРГ, соматостатин и дексаметазон.
Несмотря на множество перспективных разработок, большинство специалистов по-прежнему рекомендуют кастрацию и прием антиандрогенов с заменой препаратов или увеличением дозы. Рассматривают следующие варианты тактики ведения в дополнение к терапии максимальной андрогенной блокады:
- Химиотерапия. Доцетаксел — первый одобренный химиотерапевтический препарат для лечения метастатического гормонорефрактерного рака простаты. Его комбинация с преднизоном считается стандартом лечения. Более современное лекарство с высокой цитотоксичностью — кабазитаксел. Это препарат второй линии, также используется в сочетании с преднизоном в случаях, когда не удалось получить адекватный ответ на терапию доцетакселом.
- Иммунотерапия. Сипулеуцел-Т — представитель нового направления (вакцинотерапии) для лечения гормонорезистентной опухоли простаты. При его введении запускается специфическая активация собственной иммунной системы, которая начинает бороться с опухолевой массой. Вакцина изготавливается для каждого пациента индивидуально, на основе взаимодействия его Т-лимфоцитов с гибридным белком.
- Современные антагонисты гормонов. Антиандрогены первого поколения могут быть заменены на абиратерона ацетат — селективный ингибитор CYP17, коэнзима цитохрома Р450, который способствует подавлению выработки внегонадного тестостерона за счет угнетения активности фермента в надпочечниках, простате, опухолевой ткани, яичках. Энзалутамид — суперселективный антиандроген, его действие направлено на максимальное подавление синтеза тестостерона после прогресса онкологического процесса на фоне терапии доцетакселом.
- Таргетная радиационная терапия. Радия-223 дихлорид — радиофармпрепарат для проведения таргетной радионуклидной терапии. Токсичность от воздействия на организм минимальна. Таргетная терапия подразумевает доставку системного излучения выборочно к опухолевой клетке. Радиофармпрепарат связывается с ионами кальция и направленно подавляет активность костных метастазов. Учитывая малодоступность препаратов для целевой радиотерапии, преимущественно используют бисфосфонаты, чтобы предупредить скелетные осложнения.
Профилактика и прогноз
Прогноз связан с несколькими факторами, включая местную распространенность опухоли, наличие висцеральных и костных метастазов. Показатели безрецидивной и общей выживаемости составляют 12-24 и 24-36 месяцев. Нет доказанной стратегии в профилактике рака простаты, но риск развития патологии можно уменьшить с помощью рационального питания, которое включает низкокалорийную диету с превалированием растительных жиров, достаточное потребление фруктов и овощей, продуктов, богатых омега-з жирными кислотами. Не менее важен здоровый образ жизни с ежедневной физической активностью, регулярные сексуальные отношения. Для своевременного выявления злокачественного новообразования простаты всем мужчинам старше 40 лет необходим ежегодный осмотр урологом.
Источник
Комментарии
| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 10. Вторая линия эндокринной терапии рака предстательной железы и лечение гормонорезистентного рака предстательной железы
Наиболее сложная проблема в лечении рака предстательной железы возникает при наступлении, так называемой, вторичной гормонорезистентности, или в тех 15-20% случаях, когда опухоль первично резистентна к гормональному лечению. По мнению проф. А.М. Гарина (1997), самый тяжелый период в жизни больных распространенным раком предстательной железы наступает с момента прогрессирования на фоне максимальной андрогенной блокады или антиандрогенного подавления тестикулярного тестостерона. Здесь их жизнь измеряется уже месяцами.
Принципы второй линии терапии рака предстательной железы основываются на следующих постулатах. Фенотипически опухолевые клетки в предстательной железе состоят из 3 типов:
а) андрогензависимые (для продолжения их роста и выживания требуется андрогенная стимуляция). Такие клетки погибают при андрогенной блокаде;
б) андрогенчувствительные, они не погибают при отсутствии андрогенов, но их рост при этом ослабляется;
в) андрогеннезависимые — для их роста не требуются андрогены и они продолжают пролиферировать (Isaacs J.Т. et al., 1992).
Таким образом, андрогенная блокада приводит лишь только к элиминации андрогензависимых опухолевых клеток.
Широкое применение эстрогенов, как препаратов второй линии гормонотерапии, обусловлено тем, что многие авторы считают, что эстрогены обладают прямым цитотоксическим действием на клетки рака предстательной железы. В связи с этим, считается оправданным использование высоких доз эстрогенов, несмотря на возможность побочных действий.
Если после прекращения действия андрогенной блокады уровень сывороточного тестостерона остается выше кастрационного, то не все эндокринные возможности исчерпаны. Известно, что прогестины подавляют гонадотропины и тормозят превращение тестостерона в активный внутриклеточный дериват дигидротестостерон, они также конкурируют с андрогенами за рецепторы. Эффект при применении препаратов прогестинового ряда может быть получен у 15-20% больных. На заседании Американского общества клинической онкологии (ASCO) в 1998 г. в сообщении Dawson N.A. приведены данные об исследовании двух доз мегестрол ацетата — 160 мг и 640 мг. Объективный ответ в виде снижения уровня ПСА был достигнут у 12% пациентов, причем зависимости эффект — доза выявлено не было.
Выраженного субъективного эффекта в 20% наблюдений удается добиться от применения аминоглютетимида, создающего ситуацию медикаментозной адреналэктомии. Аминоглютетимид нарушает превращение холестерола в прегненолон, блокируя 20-24 десмолазу. При этом во избежание аддисонова криза необходимо одновременное назначение кортикостероидов. Однако по данным, приводимым Mahler Ch., (1997), значимого увеличения выживаемости не отмечено. Низкие и средние дозы стероидов подавляют надпочечниковые андрогены. Симптоматический эффект описан у 60% больных после применения дексаметазона в дозе 0.75 мг 2 раза в день. Одновременно отмечается снижение уровня ПСА более чем на 50% у большинства больных. В 30% имеются доказательства рентгенологического улучшения. Выживаемость составляет 6-9 месяцев.
Представляют интерес сообщения об определенной эффективности высоких доз кетоконазола. Кетоконазол — антигрибковый препарат, который нарушает функционирование цитохрома Р 450, и тем самым, угнетает надпочечниковый и тестикулярный синтез андрогенов. Применяются дозы 800-1200 мг в день. Первые исследования продемонстрировали объективный эффект в 16% и стабилизацию в 30% наблюдений. В некоторых сообщениях приводятся данные о снижении уровня ПСА на 90% у 50% больных. Описаны даже полные ремиссии продолжительностью до года. В более поздних исследованиях сообщается о средних сроках длительности ремиссии в 8.5 месяцев и медиане выживаемости — 19 мес. (Small E.J. et аl., 1997). Побочные действия кетоконазола проявляются в виде слабости, сонливости, тошноты, рвоты и снижения либидо. Заслуживают внимания сообщения о сочетании кетоконазола с адриамицином, которое вызывает снижение уровня ПСА более 50% у 57% пациентов гормонорефрактерным раком предстательной железы (Stemberg С.N., 1998). В настоящее время проводятся рандомизированные исследования нового деривата имидазола — Лиарозола, обладающего меньшим количеством побочных действий.
Описывается эффект повышенных доз тамоксифена у гормонрезистентных больных. Этот эффект отмечался при дозах 80 мг/м2 х 2 раза в день у 38% пациентов, ремиссия продолжалась несколько месяцев.
Определенный интерес представляет, так называемый, синдром отмены антиандрогенов. У пациентов, прогрессировавших после длительного применения МАБ, после отмены антиандрогенов было отмечено значимое снижение уровня ПСА и даже регрессия первичной опухоли. Этот пародоксальный эффект впервые был зафиксирован при отмене флутамида (Scher H.I., Kelly W.K., 1993; Dupont A., et al., 1993). Позднее подоеный синдром был зарегистрирован для двух нестероидных антиандрогенов — анандрона и касодекса, а также стероидных — мегестрол ацетата и хлорамидинон ацетата, Точный механизм возникновения данного феномена неизвестен, однако считается, что он связан с мутацией андрогенных рецепторов. Показано, что снижение уровня ПСА отмечается у 38%-54% пациентов, причем средняя продолжительность эффекта составляла 2-4 месяца.
До настоящего времени остается открытым вопрос об использовании антиандрогенов как второй линии терапии. Поданным А.М. Гарина (1997), складывается впечатление, что касодекс (бикалутамид) конкурирует с флутамидом и анандроном в практике лечения рака предстательной железы. На ASCO в 1996 году и на XIII конгрессе Европейской ассоциации урологов в Барселоне в 1998 году была представлена серия докладов, посвященных этому препарату. Есть работы, в которых отмечено улучшение от касодекса после прогрессирования на фоне лечения флутамидом (Liebertz С. et аl., 1995). В последнее время проходят испытания высоких доз касодекса — 150 мг, показывающие очень обнадеживающие результаты. Так Fourcade R.O. и Potere М., 1998, показали в сравнительном исследовании на 120 пациентах распространенным раком предстательной железы, что монотерапия касодексом (150 мг) равно эффективна кастрации. На основании полученных данных они считают, что касодекс может считаться альтернативой кастрации при лечении прогрессирующего рака простаты.
Химиотерапия рака предстательной железы. По мнению известных химиотерапевтов, в частности А.М. Гарина (1997), место химиотерапии в системе лечения рака предстательной железы последнее. Лучшим критерием активности химиотерапевтических средств считается падение уровня ПСА, поскольку другие объективные критерии плохо измеряемы и присутствуют лишь у 10% больных. В расчет принимаются качество жизни, субъективный эффект — снятие болей, улучшение общего самочувствие и т.п.
Результаты использования цитостатиков при лечении диссеминированного рака предстательной железы остаются неудовлетворительными. При развитии резистентности к гормонотерапии объективной частичной регрессии опухоли удается добиться менее чем у 10% больных. При изучении эффективности 26 цитостатиков у больных гормонорезистентным раком предстательной железы, положительные результаты составили 8.7% (6.4-9%). Только 6 цитостатиков демонстрируют эффективность 10% и более, среди них винбластин (инфузии), триметрексат, эстрамустин, цисплатин. В ОНЦ РАМН была исследована эффективность отечественного препарата второго поколения соединений платины — циклоплатама. Лечение проведено 26 больным гормонорезистентным раком предстательной железы. Циклоплатам вводился внутривенно капельно на 5% растворе глюкозы из расчета 80-100 мг на м2 площади тела ежедневно в течение 5 дней. Курс повторялся через 28 дней. Эффективность циклоплатама составила: частичная регрессия — 8.7%, минимальная частичная регрессия ( Активностью в диапазоне 10-20% обладают антрациклины, митоксантрон, эстрамустин, цисплатин, винбластин, фторурацил, циклофосфан. Средняя выживаемость больных, получавших химиотерапию — 40-48 недель. Результаты монохимиотерапии различными препаратами, изучавшимися за последние 10-15 лет, приведены в табл. 62.
Таблица 62. Эффективность монохимиотерапии в лечении диссеминированного рака предстательной железы (Rubben Н. ,1997).
| Химиопрепарат | Кол-во больных | Общий ответ | Авторы | |
| n | % | |||
| Цисплатин (Cisplatin) | 54 | 24 | 44 | Merrin (1979) |
| 25 | 4 | 16 | Yagoda et al. (1979) | |
| 21 | 4 | 19 | Rossof et al. (1979) | |
| 17 | — | Qazi et fl. (1983) | ||
| 29 | 3 | 10 | Moore et al. (1986) | |
| Циклофосфамид (Cyclophosphamid) | 57 | 8 | 14 | Carter et al. (1975) |
| Доксорубицин (Doxorubin) | 25 | 21 | 84 | Torti et al. (1983) |
| 51 | 7 | 14 | Blum (1975) | |
| 39 | 3 | 8 | Scher et al. (1984) | |
| Этопозид (Etoposide) | 5 | 2 | 40 | Nissen et al. (1984) |
| 36 | 5 | 14 | Walther et al. (1986) | |
| 5-Фторурацил (5-Fluorouracil) | 7 | 1 | 14 | Ansfield et al. (1962) |
| 4 | 1 | 25 | Weiss et al. (1961) | |
| 6 | 3 | 50 | Hall et Good (1962) | |
| Ломустин Lomustine | 19 | 2 | 11 | Carter et al. (1975) |
| Мелфалан Melphalan | 15 | 1 | 7 | Houghton et al. (1977) |
| Митрамицин Mithramycin | 36 | 2 | 6 | Carter et al. (1975) |
| 6 | 2 | 33 | Kofman et al. (1963) | |
| Митомицин-С Mitomycin-C | 4 | — | Humpherey et al. (1961) | |
| 31 | 9 | 29 | Jones et al. (1986) | |
| Митоксантрон Mitoxantrone | 25 | 15 | 60 | Otto et al. (1996) |
| Винбластин Vinblastine | 39 | 8 | 21 | Dexeus et al. (1985) |
| Винкристин Vincristine | 22 | 2 | 9 | Carter et al. (1975) |
| Виндезин Vindesine | 27 | 16 | 59 | Jones et al. (1983) |
Результаты полихимиотерапии гормонорефрактерного рака предстательной железы несколько лучше, однако весьма далеки от желаемых. Различные комбинации цитотоксических препаратов и их эффективность приведены в табл. 63.
Таблица 63. Эффективность полихимиотерапии в лечении гормонорезистентного рака предстательной железы (нерандомизированные исследования).
| Вид лечения | Кол-во больных | Общий ответ | ПР + ЧР | Авторы | ||
| n | % | n | % | |||
| Циклофосфан + Доксорубицин | 20 | 8 | 40 | 3 | 15 | Izbick et al. (1979) |
| 22 | 11 | 50 | 8 | 32 | Ihde et al. (1980) | |
| 19 | 5 | 26 | — | Merrin et al.(1976) | ||
| 11 | 2 | 18 | 2 | 18 | Lloyd et al. (1976) | |
| 21 | 12 | 57 | — | Solowayet al. (1979) | ||
| 35 | 46 | Fischer et al. (1997) | ||||
| Эстрамустин + 5-фторурацил | 25 | 3 | 12 | — | Kennealey et al. (1978) | |
| Доксорубицин + Платидиам | 21 | 10 | 43 | б.э. | — | Citrin et al. (1982) |
| 17 | 9 | 53 | 9 | 53 | Perloff et al. (1977) | |
| Циклофосфан + Доксорубицин + Платидиам | 17 | 12 | 71 | 7 | 41 | Ihde et al. (1981) |
| Циклофосфан + Платидиам + Преднизон | 22 | 10 | 45 | — | Berry & MacDonald (1982) | |
| Доксорубицин + 5-ФУ + Митомицин С | 62 | 3 | 48 | б.э. | — | Logothetis (1983) |
| 16 | 7 | 44 | — | Kasimis et al. (1983) | ||
| 14 | 9 | 64 | 1 | 7 | Hsu & Babaian (1983) | |
| 5-ФУ + Метотрексат + Винкристин + Мефалон + Преднизон | 84 | 30 | 36 | 3 | 4 | Paulson et al. (1979) |
| 5-ФУ + Циклофосфан | 50 | 34 | 68 | 14 | 28 | Gratf et al. (1990) |
А.М. Гарин с соавт., (1995), предлагают несколько схем полихимиотерапии рака предстательной железы.
IFP — Ифосфамид 2 г в/в, 1-3 дня
Фторурацил 250 мг в/в, 1 -5 дней
Цисплатин 30 мг в/в, 1-5 дней
Интервал между первыми тремя курсами 3-4 недели, далее по 6-8 недель. (Всего 6 курсов).
AC — Адриамицин 40 мг/м2 в/в, 1-й день
Циклофосфан 200 мг/м2 внутрь, 3-6 дней
Циклы повторяются каждые 28 дней.
АСВ — Адриамицин 40 мг/м2 в/в, 1-й день
Циклофосфан 100 мг/м2 внутрь, с 1-го по 10 день
Кармустин 80 мг/м2 в/в, 1-й день.
Циклы повторяются каждые 6 недель.
CAF — Циклофосфан 400 мг/м2 в/в, 1-й и 8-й день
Адриамицин 40 мг/м2 в/в, 1-й и 8 день
Фторурацил 400 мг/м2 в/в, 1-й и 8-й день
Циклы повторяются каждые 28 дней.
САМ — Циклофосфан 1 г/м2 в/в, 1-й день
Адриамицин 30 мг/м2 в/в, 1-й день
Метотрексат 20 мг/м2 в/в, 1-й день
Повторный цикл через 4 недели.
РАМ — Фторурацил 600 мг/м2 в/в, 1, 8, 29 и 36-й день
Адриамицин 30 мг/м2 в/в, 1-й и 29 день
Митомицин 10 мг/м2 в/в, 1-й день
Повторные курсы через 3 недели.
Вопросам химиотерапии диссеминированного гормонорефрактерного рака предстательной железы уделялось большое внимание на ASCO в 1996 и 1998 гг. По данным этих симпозиумов, комбинация малых доз преднизолона (5 мг 2 раза в день) и митоксантрона (12 мг/м2 1 раз в 3 недели) привела к достижению объективной и субъективной ремиссии у 22 из 80 гормонорефрактерных больных. Продолжительность эффекта составила в среднем 43 недели. В контрольной группе, получавшей только преднизолон результаты были достоверно хуже.
Произведена оценка комбинации фторурацила (вводимого длительно 200 мг/м2 в день в течение 18 недель), эпирубицина (40 мг/м2 внутривенно) и цисплатина (60 мг/м2 внутривенно). Препараты назначались 1 раз в 3 недели. Противоопухолевый эффект со снижением ПСА более 50% достигнут в 38% наблюдений. Продолжительность улучшения составила 9 месяцев.
От комбинации этопозида (50 мг внутрь 2 раза в день), цисплатина (70 мг/м2) и эстрамустина (10 мг/кг 2 раза в день) в течение 2 недель с повторением циклов каждые 28 дней, достигнуты ремиссии в 61% случаев. Продолжительность эффекта составляла 6 месяцев. Комбинация Эстрамустина с винбластином обладает эффективностью в 25-54% наблюдений, а эстрамустина с таксотером — в 62%. Сочетание эстрамустина, винбластина, доксорубицина и кетоконазола была эффективной в 75% наблюдений.
Замечен противоопухолевый эффект антитрипаносомного препарата Сурамина (полисульфонат нафтилмочевины). В механизме действия этого агента — связывание рецепторов факторов роста (фибробластного инсулиноподобного и тромбоцитарного). К сожалению, у данного препарата низкий терапевтический индекс. Нейропатии, коагулопатии и надпочечниковая недостаточность встречаются у большинства больных. Вместе с тем, на ASCO последних лет была представлена серия докладов, посвященных сурамину. Считается, что для достижения эффекта должна поддерживаться стабильная концентрация препарата в плазме (285 мг/мл). В этом случае эффективность его составляет 33%, а ее продолжительность — 22 недели. Сурамин комбинируют с полной андрогенной блокадой, при этом 2-х годичная выживаемость больных с метастатическим раком предстательной железы составляет 84% (Dawson N.A. et al.,1995). Комбинация сурамина с гидрокортизоном позволила снизить уровень ПСА более 50% у 43% из 178 больных и привела к частичной регрессии опухоли у 22% из 140 пациентов гормонорезистентным раком предстательной железы (Stemberg С.N.,1998).
Определенные надежды возлагают на ретиноиды (витамин А и его дериваты). Они, как оказалось, тормозят пролиферацию клеток рака предстательной железы in vitro. Уменьшают частоту первичных и метастатических опухолей у крыс, у которых спонтанно развивается рак простаты.
Проявлен интерес к комбинациям альфа-интерферона и ретиноидов. Причем, комбинация активнее употребления каждого из препаратов в режиме монотерапии. Отмечено снижение концентрации сывороточного ПСА у 40 резистентных к гормонам больных.
Совершенно необычные результаты были представлены на ASCO в 1996 г. Damie R. et al. Так ими приведены результаты исследования, в которое вошли 18 больных с прогрессированием рака предстательной железы на фоне гормонотерапии. У всех у них вырос ингибиторный фактор интерферона (IIF) и не продуцировался собственный. Интерферон вводили по пульсовой методике 3 дня в 4 недели, и так в течение двух лет, доза титровалась по концентрации в плазме. Через 12 месяцев полная ремиссия была у 8 из 18 (44%) и частичная у 3 (16.6%, через два года полная ремиссия у 10 из 18 (55%) и у 3 исчезли метастазы в кости, средняя выживаемость — 6 лет.
В ряде пилотных исследований выявлена принципиальная чувствительность рака предстательной железы к таксолу и навельбину. Среди новых препаратов, получающих противоопухолевую оценку при раке предстательной железы — маримостат (ингибитор матрикс металлопротеиназ), финастерид, эпристерид и туростерид (ингибиторы 5-альфа редуктазы), которые уменьшают интрапростатическую концентрацию дигидротестостерона, фенилбутират, тормозящий пролиферацию клеток рака простаты и уменьшающий выработку ПСА. Кроме того проявляется интерес к ингибиторам фактора роста — Со-матостатину и его аналогам, показавшим определенную эффективность в эксперименте на крысах.
Литература
Гарин А.М. 2-я линия эндокринной терапии и химиотерапия генерализованного рака предстательной железы. Материалы Европейской школы онкологов. ОНЦ им. Н.Н. Блохина, М. -1997.
Гарин А.М., Хлебнов А.В. Справочник практической химиотерапии опухолей. М. -1995.
Damie R., Long P. Caglayan S. et al. Prostate carcinoma response to interferon therapy. ASC0 1996, 692.
Dawson N.A. Hormonal therapy for prostate cancer: What you need to know. ASC0 1998, p. 368-372.
Dawson N.A. Steinberg S.M., Figi W.D. et al. A phase 11 trial of leuprolide, flutamide and suramin, in previously untreated metastatic prostate cancer. // ASC0 1995, 617.
Dupont A., Gornez J., Cusan L. et al. Response to flutamide withdrawal in advansed prostate cancer in progression under combination therapy. // J. Urol., 1993, vol.,150, p.908-913.
Fourcade P.O., Chalclain С., Poterre М. An open multicentere randomised stadyto compare the effekt and safety of casodex 150 mg monotherapy with castrathion plus nilutamide in metastatic prostate cancer. Abstr. From the XIII th congress of the EAU, Barselona, 1998. -349.
Isaacs J.T., Lundmo P.I., Berges R. et al. Androgen regulation of programmes cell death of normal and malignant prostatic cells. J. Androl. 1992, Vol. 13, p. 457-464.
Uebertz C., Kelly W.K., Theodoulou M. et al. High dose casodex for prostate cancer: PSA declines in patients with flutamide withdrawal responses. ASC0 1995, 603.
Mahler Ch. Secondare hormonale treatment. First International consultation on prostate cancer. Monaco, 1996, p.305-314.
Fiubben H. Treatment of hormone resistant disease. First International consultation on prostate cancer. Monaco, 1996, p.325-342
Scher H.I., Kelli W.K. Flutamide withdrawal syndrome. J Clin Oncol, 1993, Vol. 11, p. 1566-1572.
Small E.J., Egan B., Apodika D., Fippin C. Ketoconazole retains significant activity in patients with advansed prostate cancer who have progressed despite flutamide withdrawal. ASC0 1996, 657.
Stemberg C.N. Hormone refractory prostate cancer. ESU Symposium Hormone Escaped Prostate Cancer. St.Petersburg, 1998.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник