Лечение рака предстательной железы после простатэктомии
Оперативное удаление опухоли, облучение и химиотерапия не являются 100% гарантией исцеления рака предстательной железы. Благополучный исход определяют ранее выявление онкологии и выраженность злокачественного процесса. Через 5 лет после лечения больше чем у 1/3 пациентов обнаруживается рецидив рака простаты, через 10 лет РПЖ повторно диагностируют у > 50% мужчин. Под рецидивом понимают пальпаторно определяемую опухоль, метастазы и повышение показателей ПСА.
Этиология и патогенез
Возвращение болезни после операции происходит в результате неполного удаления раковых клеток. Последующие радио- и химиотерапевтические мероприятия по разным причинам оказываются неэффективными. Формируется новая опухоль либо обнаруживаются метастазы. Рецидив рака простаты чаще развивается у пациентов, начавших борьбу с онкологией поздно, на 3–4-й стадиях болезни. В этой ситуации онкологический процесс возобновляет метастатический узел.
Различают два вида рецидива:
- Местный (локальный) – поражает только предстательную железу. Обычно наступает через 2 года после операции. Характеризуется повышением уровня ПСА в 2 раза.
- Системный – в онкологический процесс вовлекаются другие органы. Биохимический рецидив развивается быстро – ПСА за год после РПЭ увеличивается более чем в 2 раза.
Новая волна злокачественного процесса возникает в результате некорректного либо запоздалого лечения. Возобновить рак может дессеминация организма мутировавшими клетками. Основные причины рецидива.
- неполное удаление опухоли в ходе операции;
- неэффективность лучевой и химиотерапии;
- позднее начало терапии (при 3–4 степени).
Полное излечение от рака простаты возможно при первых двух стадиях при условии своевременного лечения. Риск возвращения онкологии повышает прорастание опухоли в близлежащие органы.
Симптомы и проявления
Начало заболевания проходит незаметно. Первые симптомы местного рецидива возникают по мере роста раковой опухоли и сдавливания ею мочеиспускательного канала. Возникают проблемы с мочеиспусканием, потенцией и эякуляцией. Характерные симптомы:
- ощущение наполненности мочевого пузыря;
- частые позывы, вялая струя урины;
- беспрерывные боли в паху;
- нарушение потенции, ее отсутствие;
- боли при семяизвержении;
- наличие крови в эякуляте;
- эпизодические боли внизу живота.

Задайте вопрос врачу-урологу!

Колоколов В.Н.
Запущенные стадии характеризуются разрастанием опухоли за границы капсулы железы, поражением окружающих тканей, прогрессивным метастазированием в соседние и отдаленные органы. Далее процесс распространяется на поясничный сегмент позвоночника, кости таза и конечностей. Эта стадия проявляется:
- сильными болями в позвоночнике, тазу;
- появлением неврологических расстройств;
- повышением частоты патологических переломов;
- хронической усталостью и слабостью;
- утратой аппетита, сильным похуданием.

Для инфильтрации опухоли в прямую кишку характерны проблемы с дефекацией (запоры, опорожнения с кровью). Достаточно быстро в злокачественный процесс вовлекаются легкие, печень, почки и головной мозг. Развивается последняя стадия рака, обычно с печальным финалом. Клиника системного рецидива РПЖ зависит от топографии метастазирования:
- в легких – боль в грудине, кашель, кровохаркание;
- печени – боль, увеличение печени, желтизна, отеки;
- почках – боли в пояснице, гематурия, дизурия;
- в мозге – сильные головные боли, тошнота.
Для поздних стадий рецидива рака простаты после РПЭ характерны общее истощение, кахексия с признаками интоксикации (повышение температуры тела, лихорадочное состояние).
Диагностика
После оперативного удаления опухоли и специфического лечения пациенты наблюдаются у уролога-онколога. Контролируется уровень ПСА – маркера карциномы простаты. Предположением на возвращение рака простаты будет повышение результатов выше 0,2 нг/мл. Это является поводом к обследованию. Диагностические мероприятия:
- Ректальный осмотр. Выявляет местный рецидив рака на этапе, когда опухоль разрослась и пальпируется через стенку прямой кишки.
- Опрос и осмотр пациента, выявление жалоб. Выясняется состояние больного: наличие и выраженность болей, потеря в весе.
- Биохимическое тестирование. Анализы крови (общий развернутый, на сахар, ПСА) и мочи.
- Аппаратные методы (ТРУЗИ, МРТ, КТ) – дают возможность определить рецидив на раннем этапе. Томография позволяет обнаружить метастазы.
Проводятся ПЭТ (двухфотонно-эмиссионная томография), сканирование с фтордезоксиглюкозой. Перед исследованием вводится радиофармпрепарат, маркирующий атипичные клетки.
Как проводится лечение
Тактика и длительность лечебных мероприятий рецидива рака простаты после лучевой терапии и операции отличаются и зависят от первичной методики. При недостаточной эффективности облучения назначается химиотерапевтический курс либо альтернативный метод. При местной форме эффективна дистанционная радиотерапия. Системный рак простаты лечат специфическими гормональными препаратами. Новыми эффективными методами лечения рецидива РПЖ являются следующие.
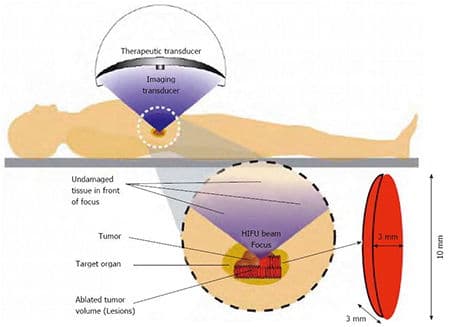
Спасительная (сальважная) HIFU терапия – при местном расположении опухоли у пациентов, перенесших полную простатэктомию. Используется высокоинтенсивный фокусированный ультразвук (High Intensity Focused Ultrasound).
Фотодинамическая терапия (ФДТ) — в/венное, локальное введение фотосенсибилизаторов, безопасных веществ, действующих на пораженный орган световым лучом заданной волны. Включает этапы:
- введение фотосенсибилизирующего препарата (минуты);
- накопление его в тканях-мишенях (дни);
- облучение опухоли лазером через световод (минуты);
- высвобождение токсинов, избирательно уничтожающих атипичные клетки.
Брахитерапия (контактное облучение) — источник излучения находится внутри ткани органа. При возобновлении рака простаты после облучения возможны локальная HIFU- и брахитерапия.
Пациент с диагнозом РПЖ после радикальной простатэктомии периодически обследуется у онколога. Проводится динамичное наблюдение показателей простатического антигена. При рецидиве рака терапевтическая тактика зависит от типа опухоли и характера ее прорастания. Учитываются возраст, иммунный статус, сопуствующие патологии. При биохимическом сигналом возвращения будет повышение уровня ПСА в крови. В этом случае назначается гормонотерапия с целью снижения уровня тестостерона.

Системный рецидив предполагает метастазирование раковых клеток в соседние органы и далее. Поздние стадии имеют выраженную онкологическую клинику. Метод борьбы со злокачественным процессом зависит от клинической ситуации. Мероприятия: химиотерапия, облучение, операция, гормональная терапия, фокусированная УЗ-абляция. Лекарства, назначаемые врачом при раке простаты:
- Золадекс (Гозарлин)— аналог гонадотропин-рилизинг гормона, назначается при гормон-резистентной форме патологии. Снижает уровень ПСА.
- Андрокур (ципротерона ацетат) — антиандроген, кастрационный препарат, осуществляет полную гормональную блокаду. Показания — метастазирующий и неоперабельный рак.
- Флутамид — нестероидный антиандроген. Препятствует усвоению клетками мужских гормонов. Снижает уровень тестостерона и, как следствие, ПСА.
Суть терапии биохимического рецидива РПЖ — нормализация показателей ПСА. Клинические рекомендации при малоэффективности гормональной терапии склоняются к проведению орхиэктомии (удалению тестикул).
Прогноз
Выживаемость пациентов с раком простаты довольно высокая. В среднем 80—90% своевременно оперированных остаются живы через 5 лет. Рецидивы также достаточно часты, 15—30% больным не удается одолеть онкологию. Смертность в течение 10 лет составляет 15—20 %. На статистику выживаемости влияет исходный уровень ПСА: чем меньше его показатели после радикальной простатоэктомии, тем лучше прогноз.
Выраженность распространения злокачественного процесса дает возможность оценить исход заболевания. Важным прогностическим фактором после РПЭ является положительный хирургический край. Рост новообразования по краю резекции и его выход за пределы капсулы значительно сокращают выздоровление.
В течение 5 лет у оперированных пациентов с негативным хирургическим краем вероятность рецидива — всего 20%, с позитивным — 40—60%. При прорастании опухоли в семенные пузырьки после удаления простаты местный рецидив рака возникает в 70% случаев. Хорошая 10-летняя выживаемость отмечается после брахитерапии (86%).
Вы нашли то, что искали?
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.
Источник
Целью любого вида радикального лечения рака предстательной железы (РПЖ) является излечение пациента или существенное продление его жизни.
Второй важный по значимости аспект — качество жизни.
Однако любой вид радикального лечения не исключает рецидива заболевания.
Частота рецидива зависит от радикальности проведения операции, суммы Глисона, исходного уровня простатспецифического антигена (ПСА). В стадии Т1-Т2 частота биохимического и клинического рецидива составляет 25-35%. Опыт хирургического лечения в стадии Т1 показывает, что у 33,5-66% выявляется позитивный хирургический край и у 7,9-49% — поражение метастазами лимфатических узлов.
Таким образом, 56-78% пациентам, которым проведено хирургическое лечение, в последующем требуется проведение гормональной или лучевой (адъювантной либо спасительной) терапии.
Для своевременного выявления возврата болезни нужен динамический контроль над течением заболевания. Проявление рецидива заболевания возможно в любой временной период после оперативного вмешательства, что требует наблюдения в ближайшие и отдаленные сроки. Своевременное определение рецидива позволит начать лечение второй линии и продлить жизнь больного.
Для выявления рецидива заболевания на первом этапе проводится клиническое обследование и определяется уровень простатспецифического антигена в сыворотке крови. При необходимости в последующем присоединяются инструментальные методы, а также различные виды лучевой диагностики для оценки клинического распространения заболевания.
Изменение уровня ПСА — основной показатель при проведении мониторинга после радикальной простатэктомии. Рост простатспецифического антигена, т.е. биохимический рецидив, как правило, предшествует клиническому прогрессированию. В настоящее время принято, чтобы результат единичного повышения уровня ПСА в плазме крови был вторично подтвержден до начала II линии терапии, которая будет проводиться по поводу биохимического прогрессирования.
Согласно Международному консенсусу, два последовательных показателя, равных 0,2 нг/мл или выше после радикальной простатэктомии свидетельствуют о рецидиве заболевания. ПСА не должен определяться в сыворотке через 3 нед после радикально проведенной простатэктомии. Постоянно увеличивающийся уровень ПСА свидетельствует, что в организме сохранены или появились ткани, продуцирующие ПСА.
Для больных, которым выполнена радикальная простатэктомия, это означает возникновение рецидива болезни как из-за наличия микрометастазов, которые не были выявлены или были невидимыми ранее, так и вследствие развития местного рецидива в полости таза, вероятно, из-за позитивного хирургического края, определенного в результате патологоанатомического обследования. Быстро растущий уровень простатспецифического антигена (высокая скорость прироста ПСА, короткое время удвоения ПСА) свидетельствует о наличии отдаленных метастазов. Более медленное и позднее увеличение ПСА, вероятно, означает развитие местного рецидива.
В настоящее время экспертами приняты следующие критерии, характеризующие местный рецидив или отдаленное метастазирование. Если среднее время удвоения ПСА равно 4,3 мес, вероятно появление отдаленных метастазов. Если среднее время удвоения простатспецифического антигена составляет 11,7 мес, возможно, развился местный рецидив. Важным диагностическим тестом является скорость прироста ПСА в течение года.
Если этот показатель составляет 0.75 нг/мл в год у 56% развиваются отдаленные метастазы. Помимо оценки ПСА и его кинетики, клиницисты проводят ректальное обследование, трансректальное ультразвуковое обследование с биопсией для определения местного рецидива.
Лучевые методы диагностики — сцинтиграфия скелета, компьютерная или магнитно-резонансная томография — позволяют выявить местный рецидив или наличие регионарных или отдаленных метастазов. У больных с отсутствием симптоматики эти исследования могут не выполняться, если уровень ПСА в сыворотке крови менее 30 нг/мл. хотя эти данные носят спорный характер.
Рутинное исследование костей скелета не рекомендуется у больных без симптомов заболевания. Если у пациента есть боли в костях, сцинтиграфия должна быть выполнена вне зависимости от уровня простатспецифического антигена. Следует подчеркнуть, что магнитно-резонансная томография (МРТ) имеет преимущества перед СКТ в оценке распространенности заболевания.
Местный рецидив или генерализация процесса после радикальной простатэктомии (РПЭ) в течение 10 лет после лечения имели место у 27-53% и у 16-35% больных, получавших лечение II линии в течение 5 лет после первичного лечения.
Лучевая терапия после радикальной простатэктомии
Сроки и выбор тактики лечения больных только с биохимическим рецидивом остаются противоречивыми. Возможен выбор нескольких методов лечения: лучевая терапия на ложе (анастомоз) предстательной железы, комбинированная блокада андрогенов, интермиттирующая гормонотерапия, химиогормональное лечение, мультимодальная терапия.
Поскольку предметом исследования данной работы является лучевое (гормонолучевое) лечение РПЖ, основное внимание в обсуждении данных литературы будет уделено этим видам терапии или их различным комбинациям.
Как показывают многочисленные наблюдения, уровень ПСА до начала проведения лучевой терапии является важным фактором прогноза заболевания и отдаленных результатов лечения.
В исследованиях, проведенных Wu и соавт., Schild и соавт., показано, что при уровне ПСА до начала проведения дистанционной лучевой терапии (ДЛТ) 2,5 нг/мл — только 8 и 26% соответственно. По данным Forman и соавт., безрецидивная выживаемость больных с наличием биохимического рецидива после РПЭ составляет 83% при уровне ПСА 2,0 нг/мл до начала проведения ДЛТ. По данным Nudell и соавт., показатели выживаемости без признаков прогрессирования составляют 58% при уровне ПСА 1,0 нг/мл.
На основании проведенных исследований ASTRO предложили рекомендации, согласно которым доза облучения на ложе предстательной железы после радикальной простатэктомии при уровне ПСА
В исследовании SWOG 8974 в группе высокого риска проводилась немедленная адъювантная ДЛТ на ложе предстательной железы. Показано, что у пациентов с уровнем ПСА 1 нг/мл показатели 5-летней безрецидивной выживаемости составили соответственно 34 и 0%. Полученные данные свидетельствуют, что адъювантная лучевая терапия ложа предстательной железы эффективна даже в группе высокого риска, тем не менее терапевтический эффект был выше у пациентов с низким уровнем ПСА.
Экстракапсулярное распространение опухоли (Т3) существенно увеличивает риск местного рецидива, частота которого может достигать 30% после выполнения РПЭ.
По данным мультивариационного анализа, основными факторами, влияющими на биохимический рецидив, являются:
• уровень ПСА (р>=0,005);
• дифференцировка опухоли по шкале Глисона по данным планового морфологического обследования (р=0,002);
• наличие положительного хирургического края (р
Роль немедленной послеоперационной ДЛТ оценена в нескольких проспективных исследованиях. Протокол EORTC 22911 охватил 1005 больных. Сравнивали эффективность немедленной адъювантной послеоперационной ДЛТ суммарной очаговой дозой (СОД) — 60 Гр и отсроченный курс ДЛТ в СОД — 70 Гр, проводимый после рецидива у больных раком предстательной железы стадии pT3аN0M0 после проведенной операции и окончательного гистологического заключения. Результаты показали, что немедленная послеоперационная ДЛТ хорошо переносится больными с риском развития осложнений 3-4-й степени менее 3,5% без существенных различий частоты развития стриктур анастомоза и недержания мочи.
Принципиально важным является то, что немедленная ДЛТ после РПЭ достоверно улучшала показатели 5-летней выживаемости больных (72,2% против 58,1%; р
С другой стороны, исследование EORTC не продемонстрировало увеличения показателей опухолево-специфической выживаемости без метастазов. Как показали данные, наиболее подходящими кандидатами для ДЛТ в послеоперационном периоде являются пациенты с мультифокальным положительным хирургическим краем, а также с дифференцировкой опухоли по Глисону >7.
Параллельно проводилось исследование SWOG 8794, в котором участвовало 425 больных РПЖ рТ3 стадии с медианой наблюдений 11,5 года. Было показано, что немедленная ДЛТ после РПЭ достоверно увеличивает до 40% выживаемость без метастазов в течение 15 лет, а в группе отсроченного лучевого лечения — до 38% (р=0,053).
Большое рандомизированное исследование проведено рядом европейских клиник у больных раком предстательной железы с высоким риском. После радикальной простатэктомии 1413 пациентов с ПСА >20, или с Т3-Т4, или индексом Глисона >7 включены в исследование. Из 1413 больных 800 отвечали критериям включения и были разделены на две группы по 400 в каждой. В одной не проводили адъювантного лечения, а в другой выполняли ДЛТ, или гормонотерапию (ГТ), или комбинацию ДЛТ и ГТ.
Авторами проведен подробный анализ выживаемости в течение 5 и 10 лет наблюдения. Рутинное назначение ДЛТ, ГТ или их сочетания не влияло значительно на частоту биохимического рецидива. Также частота клинического рецидива, общая и скорректированная выживаемость существенно не отличались между собой. Вероятно, последующие исследования должны показать, у каких пациентов с высоким риском адъювантная терапия может оказать положительный эффект на течение заболевания и продолжительность жизни больных.
Как уже упоминалось выше, одним из негативных факторов, влияющих на результаты лечения, являются позитивные хирургические края. Целью исследования A. Briganti и соавт. было изучение эффективности адъювантной лучевой терапии в стадии рТ2 с положительными краями. Проанализированы данные 2885 больных рТ2. ДЛТ проведена 1611 (55,8%) пациентам. Оценка результатов проводилась только у пациентов с негативными лимфоузлами и позитивными хирургическими краями. По этим критериям 338 (20,9%) больных были включены в исследование.
Средний возраст пациентов составил 64,5 года, по индексу Глисона они распределились следующим образом: 6 — 47,5%, 7 — 46,6%, 8-10 — 6,2%. Общая ПСА-безрецидивная выживаемость составила на протяжении 5, 8 и 10 лет после только хирургического вмешательства 85, 79 и 69% соответственно. Сравнение групп хирургического лечения с адъювантной лучевой терапией не выявило достоверных различий по выживаемости (р=0,3) в эти же сроки наблюдения. Проведенный мультивариационный анализ показал, что лучевая терапия (р=0,8) так же, как и предоперационное значение простатспецифического антигена (р=0,2), не коррелировали с биохимической безрецидивной выживаемостью.
Достоверное значение для результатов выживаемости пациентов имела сумма Глисона. Таким образом, при локализованном раке (рТ2) и положительных хирургических краях не продемонстрировано эффективности адъювантной лучевой терапии в увеличении биохимической, безрецидивной выживаемости. По-видимому, нужны мультицентровые исследования с включением большого количества больных.
A. Briganti и соавт. изучали влияние адъювантной лучевой терапии у больных с pN+ после радикальной простатэктомии группой авторов из двух центров. Когорта больных включала 703 пациентов. Адъювантное лучевое и гормональное лечение получал 171 (24,3%) пациент. Из общего количества 532 (39,7%) получали только адъювантную гормональную терапию.
Последующий анализ показал, что лучевая и гормонотерапия значительно увеличивают опухолеспецифическую выживаемость по сравнению с только гормональной терапией. Так, при адъювантном комбинированном лечении в течение 5, 8 и 10 лет опухолево-специфическая выживаемость после хирургии составила 95,92 и 87% по сравнению с 91, 79 и 74% соответственно.
Кроме того, после ГТ у пациентов сохранялся риск умереть от рака предстательной железы в 2,1 выше, чем при комбинации ГТ + ДЛТ (р=0,027). Следовательно, адъювантная ДЛТ значительно повышает опухолеспецифическую выживаемость больных с метастазами в регионарных лимфоузлах, что подтверждает необходимость использования комбинированной терапии в послеоперационном периоде у этой группы больных.
Таким образом, больные локализованным РПЖ или в клинической стадии T4N0M0 при установлении гистоморфологической стадии pT3N+ с высоким риском биохимического или клинического рецидива после РПЭ могут нуждаться в адъювантном лечении. Наличие положительного хирургического края, экстракапсулярная инвазия, вовлечение семенных пузырьков, рост ПСА после оперативного лечения требуют адъювантного лечения.
После согласования с пациентом, разъяснения вида лечения и побочных эффектов в зависимости отданных обследования, клинической ситуации может быть принято решение:
1) немедленная ДЛТ на область предстательной железы;
2) тщательное динамическое наблюдение с последующей ДЛТ при повышении ПСА >0,5 нг/мл. При уровне ПСА >1,0 нг/мл возможность локального контроля над опухолевым процессом значительно снижена.
Анализ данных литературы показывает, что проведение спасительной ДЛТ в отдаленные сроки от оперативного вмешательства также увеличивало опухолеспецифическую выживаемость больных в случае появления биохимического или локального рецидива заболевания.
В настоящее время продолжается ряд исследований по использованию ДЛТ, гормонотерапии, химиотерапии и их комбинаций в адъювантном режиме. Обобщенные данные позволят дать ответы, какие виды комбинаций адъювантной терапии позволят увеличить продолжительность и улучшить качество жизни больных раком предстательной железы.
В.И. Чиссов, Б.Я. Алексеев, И.Г. Русаков
Опубликовал Константин Моканов
Источник