Электрохимический лизис лечение рака предстательной железы
В статье представлены морфологические результаты применения метода электрохимического лизиса у больных раком предстательной железы. Показано, что метод электрохимического лизиса оказывает избирательное повреждение раковой опухоли предстательной железы
Введение
В последние десятилетия в онкоурологической практике большое внимание уделяют разработке и внедрению альтернативных методов лечения больных, основанных на применении различных физических факторов. К таким методам относят криотерапию, радиочастотную и ультразвуковую абляцию, лазерную интерстициальную и фотодинамическую терапию. К их числу по праву можно отнести и метод электрохимического лизиса, в основе действия которого лежит повреждение клеток опухоли вследствие химических реакций, возникающих в процессе локального воздействия электрического тока низкой интенсивности [1].
На текущий период времени в отечественной и зарубежной медицинской литературе представлено значительное количество исследований, посвященных экспериментальному и клиническому применению метода электрохимического лизиса в лечении больных доброкачественными и злокачественными новообразованиями различных локализаций [2–9]. Результаты всех исследований, включая наше собственное [10], убедительно демонстрируют клиническую эффективность метода. Морфологические же изменения, возникающие в тканях в результате электрохимического воздействия, описаны лишь на примере узлового коллоидного зоба щитовидной железы, метастазов колоректального рака, доброкачественных образований молочных желез и представлены в единичных работах [11–13]. Изучив литературу, посвященную применению метода электрохимического лизиса, мы не встретили работ, описывающих морфологические изменения в тканях предстательной железы, подвергнутых электрохимическому воздействию.
Цель работы: в ходе клинико-морфологического исследования определить характер и выраженность морфологических изменений ткани предстательной железы и содержащейся в ней опухолевой ткани, возникающих вследствие электрохимического воздействия.
Материал и методы
Проведение настоящего пилотного исследования было одобрено Межвузовским комитетом по этике МГМСУ им. А.И. Евдокимова. Работа выполнена на базе отделений онкоурологии и патоморфологии Онкологического центра ОАО РЖД НУЗ «ЦКБ № 2 им. Н.А. Семашко», а также Смоленского областного института патологии.
Основную группу составили больные (n=18) с морфологически верифицированным локализованным раком предстательной железы (РПЖ), которым перед радикальной простатэктомией проводили сеансы неинвазивного электрохимического лизиса. Обострение сопутствующей патологии, потребовавшее коррекции, не позволило провести этим больным хирургическое лечение сразу после установления диагноза злокачественного новообразования. На время коррекции сопутствующей патологии в качестве дополнительного лечения им были проведены сеансы неинвазивного электрохимического лизиса. Контрольную группу составили больные (n=18) РПЖ, которым была проведена только открытая позадилонная радикальная простатэктомия.
Основная и контрольная группы больных статистически значимо не отличались по всем исследуемым характеристикам (табл. 1).
Сеансы электрохимического лизиса проводили на терапевтической установке BET-7 (Horst Poduchka, Германия) (рис. 1) с помощью накожных пластинчатых электродов. Длительность воздействия за 1 сеанс составляла 120–180 мин. Напряжение электрического тока в течение сеанса варьировало от 5 до 20 В, а сила тока не превышала 40 мА, что соответствовало рекомендациям компании-производителя. Каждому больному проведено от 1 до 3-х лечебных сеансов в зависимости от индивидуальных показаний. Интервал между лечебными сеансами составлял от 2-х до 4-х нед. После нормализации соматического статуса больным основной группы была выполнена открытая позадилонная радикальная простатэктомия в сроки от 5 дней до 3-х нед. после последнего сеанса лечения. 
Операционный материал без предварительной фиксации доставляли в патоморфологическое отделение в течение 1–2 часов с момента удаления. После его макроскопической оценки проводили унифицированный забор фрагментов операционного материала для гистологического исследования: по два фрагмента опухоли объемом около 125 мм2 и не пораженных опухолью участков предстательной железы. Отобранные фрагменты фиксировали в 10% растворе нейтрального формалина и подвергали стандартной гистологической проводке и заливке в парафин. Из полученных парафиновых блоков приготавливали срезы толщиной 5–7 мкм и окрашивали их гематоксилином и эозином. Микроскопическое исследование проводили световым бинокулярным микроскопом при общем увеличении ×100, ×200, ×400.
Статистический анализ полученных результатов проводили с помощью пакета прикладных статистических программ Statistica V.6.0 и 7.0 (StatSof, USA). Для представления данных в настоящем исследовании мы применяли абсолютные и относительные частоты. Для исследования значимости взаимосвязи между признаками применяли точный критерий Фишера для таблиц сопряженности 2×2 для бинарных признаков. Уровень значимости полагали равным 0,05.
Результаты исследования
Результаты макроскопического исследования удаленных предстательных желез больных основной и контрольной групп представлены в таблице 2. 
При макроскопическом исследовании предстательных желез больных, подвергнутых электрохимическому воздействию, в 5 (27,8%) наблюдениях из 18 в опухолевой ткани были выявлены очаги кровоизлияний, в то время как в контрольной группе очаговые кровоизлияния в опухолевой ткани простаты были обнаружены в 2-х (11,1%) наблюдениях из 18 (p<0,05). Другой признак, выявленный при макроскопическом исследовании, был представлен небольшими зонами размягчения и отека ткани, определялся в 11 (61,1%) наблюдениях из 18 у больных, которым проводили сеансы электрохимического воздействия. При макроскопическом исследовании препаратов больных контрольной группы очагов размягчения, подобных вышеописанным, обнаружено не было (р<0,05).
Патоморфологические изменения опухолевой ткани простаты после электрохимического воздействия на светооптическом уровне носили очаговый характер и в целом были однотипны, имели разную степень выраженности того или иного признака. Описания выявленных при микроскопическом исследовании патоморфологических изменений опухолевой ткани простаты приведены в таблице 3.
В группе больных, получавших сеансы неинвазивного электрохимического лизиса, в 7 (38,9%) наблюдениях из 18 были обнаружены зоны тотальной деструкции опухолевой ткани, представленные бесструктурными, эозинофильно окрашенными массами, среди которых местами были видны вытянутые клеточные фрагменты. Выявленные изменения соответствовали коагуляционному некрозу. Некроз, как правило, был очаговым в виде небольших полей или микрофокусов (рис. 2). Признаки воспаления на границе очагов некроза и неизмененных тканей не были выраженными. Ни в одном из изученных препаратов удаленных предстательных желез больных контрольной группы подобных изменений нами не обнаружено (р<0,05).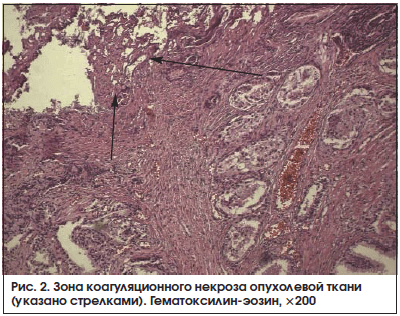
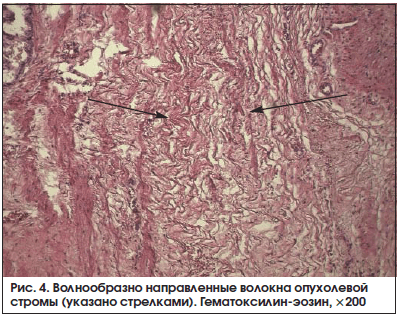
В 13 (72,2%) из 18 образцов, принадлежащих больным основной группы, мы зарегистрировали участки повреждения соединительной ткани в опухоли по типу фибриноидного набухания волокон стромы и стенки сосудов (рис. 3). Пучки соединительной ткани в данных полях зрения были неравномерно эозинофильно прокрашены, клетки стромы либо не определялись, либо были представлены в виде «теней». Нередко, в 11 (61,1%) наблюдениях из 18, выявлен отек стромы, островки ее разрыхления, местами с формированием оптически пустых пространств между волокнами. Также обнаружены волнообразно ориентированные пучки опухолевой стромы (рис. 4). Ни в одном из исследуемых морфологических препаратов железы больных контрольной группы описанные морфологические изменения опухолевой стромы не были выявлены (р<0,05). 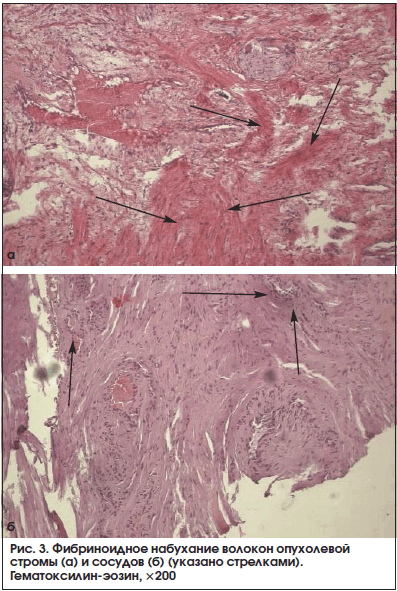
При обзорной микроскопии в 11 (61,1%) наблюдениях из 18 были зарегистрированы изменения паренхимы опухоли. Они были локализованы в зонах выраженной стромальной деструкции. Эпителиальная выстилка опухолевых желез была представлена вытянутыми клетками, сохраняющими гиперхромность ядер (рис. 5). В других полях зрения опухолевые клетки были набухшие, без четких границ, с более светлыми ядрами. Нередко измененные клетки опухоли имели вид «голых ядер». Также мы выявляли участки, где описанные выше варианты деструктивных изменений опухолевых клеток сочетались и дополнялись явлениями их десквамации разной степени выраженности. Следует отметить, что описанные повреждения мы регистрировали именно в опухолевой ткани и не обнаруживали вне зон опухолевого роста. В одном (5,6%) наблюдении из 18 в исследованных препаратах желез больных контрольной группы были представлены изменения паренхимы опухоли в виде десквамации отдельных визуально неизмененных опухолевых клеток. Отличия между группами больных по частоте встречаемости признака были статистически значимыми (р<0,05).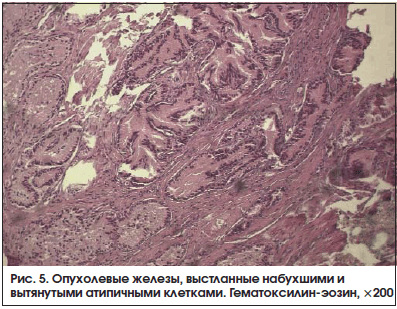
Очаговые разрастания соединительной ткани, разделяющей опухолевые железы на островки разных размеров, были обнаружены нами в 9 (50%) наблюдениях из 18 в основной группе больных. Соединительную ткань разной степени зрелости чаще всего мы определяли по периферии зон коагуляционного некроза и выраженных дистрофических изменений (рис. 6). Иногда среди фиброзной ткани мы обнаруживали разрозненные мелкие опухолевые железы с дистрофией и десквамацией выстилающих их атипичных клеток. Лишь в 2-х (11,3%) из 18 препаратов желез больных контрольной группы мы обнаружили единичные небольшие, хаотично расположенные островки склероза раковой опухоли. При этом число наблюдений данного признака у больных основной и контрольной групп различалось статистически значимо (р<0,05). 
У 6 (33,4%) из 18 больных основной группы при исследовании операционного материала были обнаружены однотипные изменения в регионарных лимфатических узлах, где на фоне атрофии лимфоидной ткани отмечено фибриноидное набухание соединительной ткани системы трабекул (рис. 7). Подобные морфологические изменения регионарных лимфатических узлов у больных контрольной группы не обнаружены.
На основании статистического анализа мы с уверенностью можем утверждать, что выявленные в нашем исследовании патоморфологические изменения паренхимы и стромы опухолевой ткани простаты, а также регионарных лимфатических узлов были вызваны электрохимическим воздействием.
Обсуждение
Описанные в работах патоморфологические изменения опухолевых тканей, подвергнутых электрохимическому воздействию, как правило, представлены различной степени выраженности дистрофическими изменениями паренхимы и стромы опухоли. Другие описанные изменения, специфичные для электрохимического воздействия, представлены участками колликвационного и коагуляционного некрозов.
Так, в своем исследовании А.В. Борсуков и соавт. [11] описали развитие некротических изменений в метастатических узлах печени, возникшие в результате электрохимического воздействия в течение 20–45 мин. Несколькими годами позднее, А.В. Борсуков и соавт. [14] представили результаты экспериментального исследования, в котором вызывали некротические изменения тканей гепатоцеллюлярного рака крыс. По результатам морфологического исследования опухолевой ткани, выполненного через месяц после электрохимического воздействия, в участках ранее определявшихся очагов некроза было обнаружено разрастание соединительной ткани с элементами лимфоцитарной инфильтрации.
С.Н. Щаева и соавт. [12] в своем исследовании описали морфологические изменения тканей удаленных доброкачественных опухолей молочных желез женщин, подвергнутых электрохимическому воздействию ex vivo. Для оценки патоморфологических изменений тканей авторы применяли гистологическую классификацию выраженности лечебного патоморфоза опухоли, предложенную Е.Ф. Лушниковым. Согласно представленным результатам, к патоморфозу I степени авторы относили умеренно выраженные очаговые дистрофические изменения опухолевой стромы. При II степени патоморфоза отмечали нарастание дистрофических изменений в виде образования гигантских клеток, вакуолизации ядер и цитоплазмы. Морфологические изменения, представленные глубокими дистрофиями в паренхиме и строме, а также определявшиеся очаговые некрозы авторы относили к патоморфозу опухолевой ткани III степени. Обширные участки некроза с отсутствием клеток опухоли были отнесены к IV степени патоморфоза опухолевой ткани.
В своем исследовании Ю.В. Иванов и соавт. [13] проводили морфологическое изучение тканей узлового коллоидного зоба щитовидной железы животных и установили, что в результате электрохимического воздействия в тканях коллоидного зоба происходит развитие некротических изменений, имеющих четкую границу с неизмененными тканями щитовидной железы. В последующем авторы наблюдали развитие демаркационного воспаления вокруг участков некроза, которое завершалось формированием зрелой соединительной ткани. Аналогичные результаты получены А.В. Борсуковым и соавт. [15, 16]. При этом авторы описали два альтернативных пути гибели клеток вследствие электрохимического лизиса: непосредственное некротическое поражение и отсроченную апоптозную гибель.
Выявленные в нашем исследовании патоморфологические изменения опухолевой ткани простаты в целом аналогичны изменениям, описанным в других работах. Патоморфологические изменения были представлены дистрофическими и склеротическими изменениями паренхимы и стромы опухоли различной степени выраженности. Важным характерным признаком электрохимического воздействия являются так называемые «электрометки», представленные волнообразно направленными волокнами стромы, зонами коагуляционного некроза с фрагментами своеобразно вытянутых клеток, а также вытянутыми и вертикально ориентированными атипичными клетками, выстилающими опухолевые железы. Другой характерный признак воздействия электрического тока – зоны колликвации в виде отека и разволокнения стромы, набухания атипичных клеток. В целом выявленные нами изменения свидетельствуют об умеренной и глубокой деструкции опухоли, закономерным исходом которой является разрастание соединительной ткани с последующим формированием соединительнотканного рубца.
Важное отличие нашего исследования от других работ в том, что электрохимическое воздействие мы проводили с помощью накожных, а не игольчатых электродов, которые имплантируют непосредственно в ткани органа или опухолевый узел. Применяя накожные пластинчатые электроды, мы получили аналогичные патоморфологические изменения при использовании неинвазивной и безопасной методики.
Таким образом, в результате проведенного исследования нам удалось выявить патоморфологические изменения опухолевой ткани простаты, возникающие вследствие электрохимического воздействия, и установить их очаговый характер. При этом мы не выявили каких-либо патологических изменений ткани предстательной железы вне зон опухолевого роста, что свидетельствует об избирательном воздействии слабого постоянного тока на ткани опухоли простаты без заметного повреждающего воздействия на ткани других участков предстательной железы.
Выводы
Согласно результатам патоморфологического исследования применение неинвазивного электрохимического лизиса оказывает избирательное повреждение раковой опухоли предстательной железы.
Источник

SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Введение
В течение многих лет для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) успешно применяется метод трансуретральной (TUR-P) резекции простаты [10, 13]. Однако постоянное стремление к использованию малоинвазивных методов и информированность врачей об осложнениях, связанных с TUR-P (кровопотеря, синдром TUR-P, уретральная стриктура и риск развития недержания мочи), стали причиной того, что большое количество применявшихся ранее методов медикаментозного и немедикаментозного лечения ДГПЖ проверяются сейчас в ходе клинических исследований или отнесены к экспериментальным методам [5, 9, 13]. При немедикаментозном лечении в последнее десятилетие используются следующие виды вмешательств: криохирургия, дилатация баллонным катетером, установка постоянных уретральных стентов, термотерапия, воздействие ультразвуком высокой мощности (HIFU), воздействие радиочастотным излучением (TUNA), фокальная экстракорпоральная гипертермия и лазеротерапия [12, 13].
В связи с большим разнообразием способов воздействия на предстательную железу необходимо знать границы применения различных видов лечения, успех которого зависит от различных факторов: типа воздействия, его мощности и продолжительности лечения, способа подвода к органу, а также от циклического отвода тепла в простате. Экспериментальное исследование этих факторов позволило бы разработать методику новых видов терапии, которая наряду с сокращением продолжительности лечения увеличила бы его эффективность и уменьшила количество осложнений. Все это требует клинико-экспериментальной проверки новых способов малоинвазивного лечения заболеваний предстательной железы. Многообещающим выглядит метод электрохимического лизиса (ЭХЛ) под УЗ-контролем в лечении ДГПЖ, так как температура в зоне воздействия не меняется. Лечебный эффект от электрохимического лизиса обеспечивается прямым некротизирующим воздействием на ткани постоянного тока и последующих продуктов электролиза тканей (рис. 1). Режим лизиса работоспособен при силе тока не менее 80 мА и длительности сеанса 30-45 мин; критерием появления зоны некроза в области воздействия — эхопозитивное образование вокруг проводника постоянного тока (электрода), находящееся в центре образования во время электрохимического лизиса под ультразвуковым контролем и сохраняющееся в течение 24 ч после лизиса [3].

Рис. 1. Биоэлектрическая основа девитализирующего механизма воздействия электрохимического лизиса на живую ткань.
Цель исследования — клинико-экспериментальная оценка возможности использования электрохимического лизиса в малоинвазивном лечении ДГПЖ под ультразвуковым контролем.
Материалы и методы
На базе ПНИЛ СГМА в течение 2005-2006 гг. проведены сеансы электрохимического лизиса на препаратах предстательной железы (n=21) после простатэктомии для отработки оптимального режима электрохимического лизиса. Методология способа трансуретрального лизиса [4] разработана совместно с заведующим кафедрой урологии с курсом урогинекологии и андрологии МГМСУ профессором Д.Ю. Пушкарем (рис. 2).

Рис. 2. Схема позиционирования биполярного электрода в простатическом отделе уретры и локализация зон некроза в процессе лизиса.
Время между удалением узлов и началом лизиса составляло не более 2-х часов. При наружном осмотре узлы были разных размеров, в среднем от 2 до 5,5 см, в капсуле, бугристые, плотной или плотноэластической консистенции, на разрезе — волокнистые, белесоватого и желто-белесоватого цвета. Гистологически соответствовали диагнозу: нодозная гиперплазия (аденома) предстательной железы, железистый или железисто-стромальный вариант.
В центр узла или по ходу простатического отдела уретры вводился биполярный платиновый электрод диаметром 2,5 мм. Адекватное позиционирование электрода осуществлялось под УЗ-контролем трансректальным датчиком 5 и 7 МГц в условиях фантома трансректального УЗ-исследования (рис. 3). Для нодозной гиперплазии в зоне периуретральных желез с формированием средней доли лизис проводили в среде, имитирующей содержимое мочевого пузыря. На препаратах использовалась оригинальная программа подбора оптимального режима электрохимического лизиса в виде изменений силы тока, продолжительности лизиса и позиции электрода. Патоморфологический материал подвергался стандартной парафиновой проводке с последующим изготовлением микропрепаратов, окрашенных гематоксилином и эозином, пикрофуксином по Ван Гизону. Методологической основой морфологической оценки эффективности электрохимического лизиса являлась теория патоморфоза тканей в ответ на внешнее воздействие.
Рис. 3. Сеанс электрохимического лизиса.


Использован фантом трансректального УЗ-мониторинга.
Результаты и обсуждение
Микроскопические изменения в зоне электрохимического лизиса отмечены как в стромальном, так и паренхиматозном компонентах аденом. Поскольку электрохимический лизис подвергался послеоперационной и аутопсийный материал, термин «некроз» может быть применен условно, более логичен — «деструкция». По этой же причине реакция ткани на воздействие в виде демаркационного воспаления, сосудистые реакции в наблюдении отсутствуют.
В исследовании отмечена разная степень выраженности деструкции ткани: минимальная (n=2), умеренная (n=2), глубокая (n=17). Слабо выраженная деструкция отмечена при воздействии на ткань силы тока 70-100 мА в течение 10-15 мин. Изменения наблюдались преимущественно в строме, носили очаговый характер, соответствовали фибриноидному набуханию. При умеренной деструкции помимо очагов фибриноидного набухания отмечены изменения железистого компонента в виде кариопикноза и кариорексиса. Умеренные изменения наблюдались при воздействии силы тока 80-90 мА в течение 15 мин. Глубокая деструкция с очагами некротического детрита, распространенным фибриноидным набуханием волокон стромы, разрушением желез, наличием «электрометок» наблюдалась в большинстве случаев исследования. Феномен «электрометки» отмечен в наших предыдущих работах по электрохимическому лизису [1-3]. Применялась сила тока от 90 до 100 мА, время воздействия от 25 до 40 мин в зависимости от размеров и УЗ-семиотики тканей (рис. 4).
Рис. 4. Гистологические препараты нодозной формы доброкачественной гиперплазии предстательной железы (ДГПЖ).

а) До лизиса.

б, в) После лизиса.
В процессе исследования была отмечена особенность: решающее значение для распространенности некроза имеет не сила тока, а продолжительность воздействия на ткань. Учитывая этот факт, можно думать о возможности регулирования объема деструкции по времени воздействия постоянного тока. Преобладание коагуляционного некроза предполагает снижение риска интраоперационного кровотечения. Во время лизиса отмечался УЗ-эффект повышения эхогенности в зоне электрохимического лизиса, что являлось критерием границ распространения полной деструкции тканей (рис. 5).
Рис. 5. Ультрасонограмма узла доброкачественной гиперплазии предстательной железы (ДГПЖ) и электрода.

а) До электрохимического лизиса (ЭХЛ).

б) Во время электрохимического лизиса (ЭХЛ).
Выводы экспериментальной части работы:
- оптимальный режим трансуретрального лизиса — сила тока 85-95 мА, длительность воздействия 35-45 мин;
- размер полной деструкции диаметром 25-30 мм, протяженность 20-25-30 мм (рис. 6);
- выявлен прямой механизм четкой регулировки объема некроза независимо от гистологической структуры тканей или различной плотности расположения сосудов в зоне электрохимического лизиса;
- технические характеристики биполярных электродов позволяют моделировать зоны некроза в объеме 360° и учитывать особенности анатомического строения простатического отдела уретры.
Рис. 6. Макроскопические признаки некроза в узле доброкачественной гиперплазии предстательной железы (ДГПЖ).


После сеанса электрохимического лизиса (ЭХЛ).
После получения результатов эксперимента трансуретральный электрохимический лизис проведен у 6 больных с доброкачественной гиперплазией предстательной железы, имевших стабильно низкий уровень PSA (до 5 нг/мл), ухудшение индекса IPSS и рост объема железы более 75 см³ Эти пациенты имели высокий анестезиологический риск (III степень) по сопутствующей соматической патологии (ИБС, нарушение ритма сердца, хроническая сердечная недостаточность) для проведения радикальной простатэктомии и стандартной ТУР железы. Критериями эффективности лечения служили: оценка жалоб IPSS, индекс качества жизни QOL, уровень PSA, данные урофлоуметрии и УЗ-мониторинг (остаточная моча, объем железы, изменения эхоструктуры по серошкальному сканированию и данные цветного допплеровского картирования — ЦДК — по количественным и качественным параметрам гемодинамики).
Таблица. Клинико-инструментальные критерии оценки эффективности трансуретрального электрохимического лизиса.
| Критерий | Время наблюдения после ЭХЛ | ||||
|---|---|---|---|---|---|
| До лизиса | После лизиса | Через 1 мес | Через 3 мес | Через 6 мес | |
| IPSS, баллы | 18 | — | 9 | 6 | 6 |
| QOL, баллы | 5,3±0,2 | — | 4,7±0,16 | 4,1±0,2 | 3,2±0,4 |
| Qmax, мл/с | 4,9±1,3 | — | 6,1±2,7 | 9,2±3,1 | 10,4±2,6 |
| PSA, нг/мл | 4,1 | 4,9 | 4,2 | 4,0 | 4,3 |
| V железы, см³ | 86±19,7 | 98±18,9 | 80,6±9,4 | 60,2±18,6 | 61±12,5 |
| Остаточная моча, мл | 137±13,5 | — | 59,1±11,4 | 56,5±8,6 | 52,1±7,3 |
После проведения трансуретральных сеансов электрохимического лизиса под трансректальным УЗ-мониторингом указанные выше симптомы стабилизировались в течение 1 мес, а затем уменьшились через 6 мес (на 35-40 % от исходного) (таблица). При УЗ-мониторировании во всех случаях отмечено появление эхопозитивного образования по всей зоне лизиса с постепенным его увеличением (рис. 7 а). В режиме ЦДК наблюдалось прогрессивное снижение линейных скоростей и проявление нарастающего стеноза сосудов артериального характера, что служит признаком нарастающего некроза тканей и тромбоза сосудов (рис. 7 б). В перифокальных зонах сохранялись признаки неравномерного низкоскоростного артериального кровотока, венозные сосуды не определялись (рис. 7 в).
Рис. 7. Трансуретральное УЗИ.

а) Эхопозитивное образование по всей зоне лизиса в предстательной железе.

б) Прогрессивное снижение линейных скоростей и проявление нарастающего стеноза сосудов артериального характера (режим ЦДК).

в) В перифокальных зонах лизиса сохраняются признаки неравномерного низкоскоростного артериального кровотока, венозные сосуды не определяются (режим ЦДК).
В качестве иллюстрации приводим одно из наших клинических наблюдений.
Клиническое наблюдение
Больной К., 75 лет, диагноз: ДГПЖ, наблюдался у уролога в течение 10 лет. Принимал альфа-блокаторы, уровень PSA стабилен: 5-8 нг/мл. В течение последних 2 лет отмечено увеличение объема предстательной железы с 48 до 85 см², по данным урофлоуметрии скорость истечения уменьшилась с 9,7 до 4,9 мл/с, показатель IPSS снизился с 4 до 12 баллов. Было решено провести трансуретральный малоинвазивный электрохимический лизис, так как пациент имел тяжелую сопутствующую патологию (бронхиальная астма, среднетяжелое течение, ИБС, стабильная стенокардия III ФК, хроническое легочное сердце, субкомпенсация).
Предстательная железа при пальцевом исследовании увеличена в 2,5 раза, срединная бороздка сглажена, плотность ее увеличена, подвижность железы сохранена, болезненность при пальпации незначительная. При трансректальном УЗИ было отмечено, что форма железы изменена (округлая), эхогенность неравномерно повышена, в периферической центральной и транзиторной зонах определялось множество узлов ДГПЖ от 8 до 15 мм с деформацией простатического отдела уретры, в периферической зоне — единичные кальцинаты. Шейка мочевого пузыря не изменена, объем остаточной мочи составил 98 мл. ЧЛС почек с обеих сторон — умеренно расширенны (до 18-22 мм).
Установлен клинический диагноз: ДГПЖ (рост из трех анатомических зон). Хроническая задержка мочи III степени.
Больному проведен трансуретральный сеанс электрохимического лизиса (1-75 мА, время лизиса 24,5 мин). Сформирован канал некроза между внутренним и наружным сфинктерами протяженностью 53 мм, диаметром 8 мм. Установлен катетер. Через 24 ч при контрольном трансректальном УЗИ признаков кровотечения нет, пассаж мочи по катетеру сохранен. Через 4 дня катетер был удален. Микция самостоятельная, 5 раз в день. Через 1 мес при урофлоуметрии скорость истечения мочи составила 5,4 мл/с, индекс IPSS-9 баллов, ночные микции уменьшились до 2 раз, объем предстательной железы до 80 см³.
При контрольном осмотре через 6 мес после лизиса: IPSS — 6 баллов, скорость истечения 10,4 мл/с, объем железы сократился до 61см³, объем остаточной мочи не превышал 52 мл.
Вывод
Таким образом, предлагаемый трансуретральный малоинвазивный электрохимический лизис доброкачественной гиперплазии предстательной железы имеет преимущества по сравнению с другими методами лечения благодаря малотравматичности, отсутствию патологического изменения температуры в зоне лечения и возможности многократного применения. При этом необходимо увеличение клинической группы наблюдения, а так же сроков инструментального мониторинга для объективизации результатов лечения.
Литература
- Борсуков А.В. Малоинвазивный электрохимический лизис злокачественных очаговых поражений печени: эволюция критериев эффективности лечения//VIII Симпозиум с международным участием «Современные методы инструментальной диагностики». — Москва, РНЦХ РАМН, М. — С.45.49.
- Борсуков А.В., Бельков А.В., Алибегов Р.А., Гассинец А.И. Малоинвазивный хирургический лизис единичных метастазов в печень: результаты 18 месяцев наблюдения после лечения//XI международная конференция хирургов-гепат?


