Гормонорезистентный рак предстательной железы лечение
Гормонорезистентный рак простаты — первичная опухоль, изначально не зависящая от уровня андрогенов, или прогрессирование заболевания на фоне достигнутого посткастрационного уровня тестостерона. Симптомы отсутствуют либо связаны с локализацией метастатических очагов и ростом новообразования. Типично усиление болевого синдрома и интоксикация. Диагностика подразумевает определение уровня ПСА, ТРУЗИ, МРТ (КТ) висцеральных органов, легких и малого таза, ПЭТ, сцинтиграфию костей скелета. Тактика может включать изменение схем гормонотерапии, назначение блокаторов выработки андрогенов надпочечников, иммунотерапию, моно- и полихимиотерапию, радионуклидную терапию.
Общие сведения
Гормонорезистентный рак простаты (гормонорефрактерный, гормононечувствительный, андроген-рефрактерный, устойчивый к кастрации РПЖ, «болезнь ускользнувших гормонов») представляет собой злокачественную, изначально гормоночувствительную опухоль, которая прогрессирует через 12-24 месяца после биорхиэктомии и гормонотерапии антиандрогенами, либо новообразование с первичной резистентностью (15-30% случаев). Четких критериев разделения между вторичной и первичной гормоноустойчивостью в онкологии нет, за основу берутся клинические признаки. Увеличение количества случаев гормонорезистентного рака простаты связано с доступностью улучшенных способов визуализации — магнитно-резонансного сканирования и позитронно-эмиссионной томографии.
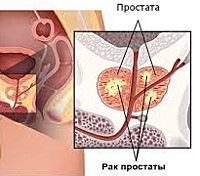
Гормонорезистентный рак простаты
Причины гормонорезистентного рака простаты
Причины развития опухолевого процесса в предстательной железе остаются неясными, заболевание относят к мультифакторным. Предполагается связь между развитием опухоли и особенностями питания (преобладание красного мяса и жирной пищи), вредными привычками, контактами с канцерогенами, неблагоприятными экологическими факторами (инсоляция, облучение), хроническим простатитом с частыми рецидивами, ИППП (ретровирусная, цитомегаловирусная инфекция, генитальный герпес), иммуносупрессией, вызванной любой причиной, генетическими факторами и предраковой патологией. Относительно причин, вызывающих гормонорезистентность РПЖ, выдвинуто несколько гипотез:
- Теория клонального доминирования. Опухолевая ткань по своей морфологии на 60% гетерогенна, т. е. представлена различными клетками: гормонозависимыми и гормононезависимыми. Под воздействием антиандрогенной терапии последние начинают доминировать.
- Теория стволовых клеток. Доказано, что стволовые клетки способствуют обновлению тканей. Длительно существующее состояние с посткастрационным уровнем тестостерона дает начало поколению новых клеток, свободных от влияния гормонов.
- Адаптивная теория. Адаптационные механизмы помогают клеткам приспособиться к сверхнизким уровням гормонов. Развившиеся в условиях гормонального дефицита, они начинают агрессивно делиться, приобретая рефрактерность к андрогенам.
Патогенез
В патогенезе заболевания прослеживаются молекулярные механизмы. В раковых клетках присутствуют нарушения экспрессии генов, контролирующих процессы пролиферации. Увеличение факторов роста и их рецепторов, активация сигнальных каскадов, связанных с андроген- и эстроген-чувствительными рецепторами, повышение активности эмбриональных сигнальных путей способствует появлению агрессивных свойств в уже видоизмененных клетках, в результате чего начинается их рост, миграция и метастатическая активность. Нарушение экспрессии генов и белков проявляется срывом контроля над апоптозом, из-за чего раковые клетки обретают устойчивость к химиотерапии. Роль эпигенетических факторов, генетических мутаций и сигнальных белков, ответственных за питание опухоли, рост и кровоснабжение, не изучена до конца.
Для развития гормонорезистентной опухоли важно соотношение между андрогенами и андрогенными рецепторами. Даже при терапии антиандрогенами и проведении билатеральной орхиэктомии надпочечники, ткани простаты и сама опухоль за счет усиленной экспрессии цитохрома P450С17 (CYP17) продолжают выработку андрогенов, которых достаточно для активации андрогеновых рецепторов в условиях низкой концентрации тестостерона.
Симптомы гормонорезистентного рака простаты
При гормонорефрактерном РПЖ клинические проявления отсутствуют либо представлены местными симптомами. Задержка мочи регистрируется у 20-25% мужчин, боль в спине и ногах ‒ у 20-40%, гематурия ‒ у 10%. Гемоспермия свидетельствует о вовлеченности в процесс семенных пузырьков. У пациентов с симптоматическим течением наиболее часты жалобы на учащение мочеиспускания (38%), ослабление струи мочи (23%), ургентные позывы (10%). Слабость, повышение температуры в вечерние часы, потливость служат общими проявлениями интоксикации. Для гормонорезистентной опухоли характерно постепенное нарастание клинических проявлений, что связано с ее прогрессированием. Из-за иммуносупрессии повышается восприимчивость к инфекциям.
Метастатические симптомы включают потерю веса и плохой аппетит, боль и ломоту в костях, образование патологических переломов, дискомфорт в нижних конечностях и отечность на фоне непроходимости венозных и лимфатических притоков при метастазах. При сдавлении опухолью или забрюшинными лимфоузлами области мочеточника и его обструкции появляются тошнота, боли в пояснице на стороне поражения, температурная реакция с ознобом, что характерно для присоединения острого пиелонефрита.
Осложнения
Урологические осложнения рака простаты могут проявиться развитием острого воспалительного процесса в мочеполовом тракте, кровотечением на фоне прорастания сосуда опухолью. При обструкции мочевыводящих путей на фоне роста новообразования часто диагностируют рефлюксы и гидронефроз, что может привести к нарушению функций почек. При назначении химиопрепаратов нередко развивается нефропатия с исходом в хроническую почечную недостаточность. Негативные последствия лечения рака предстательной железы проявляются в виде стойкой эректильной дисфункции, чему способствуют терапия андрогенной депривации (биорхиэктомия + гормонотерапия) и простатэктомия. При повреждении сфинктеров и нарушении иннервации мочевого пузыря из-за травматизации во время операции может присоединиться недержание мочи. Патологические переломы и компрессия спинного мозга — осложнения метастатического рака простаты.
Диагностика
Как правило, диагноз рака простаты уже подтвержден, пациент получает либо получил лечение, направленное на максимально возможное уменьшение выработки андрогенов. Онкологические больные с данной нозологией в обязательном порядке наблюдаются у онколога или онкоуролога, регулярно проходят необходимые исследования. Первичную гормонорезистентностиь опухоли можно предположить на основании гистологического типа (базально-клеточные, переходно-клеточные, анапластические, плоскоклеточные раки), при отсутствии ответа на антиандрогенную терапию в течение 3 месяцев, росте ПСА или при появлении новых симптомов, несмотря на прием препаратов. Общие принципы диагностики включают:
- Определения уровня ПСА и тестостерона. О биохимическом прогрессе опухолевого процесса можно вести речь, если зафиксировано последовательное увеличение уровня простатспецифического антигена (на 50% выше от минимально достигнутого) в трех анализах, при обязательном уровне тестостерона менее 50нг/дл (1,7 нмоль/л). Промежуток времени между тестами — не менее недели.
- Общий анализ крови. В результатах общего анализа крови выявляют ускорение скорости оседания эритроцитов, лейкоцитоз, анемию, что может свидетельствовать о прорастании опухоли в мочевой пузырь. Снижение гемоглобина ниже 115-120г/л и одновременный рост ПСА выше 100 нг/мл — неблагоприятный прогностический признак.
- Определение уровня ЛДГ и ЩФ. Повышение уровня лактатдегидрогеназы позволяет предположить висцеральное метастазирование. Избыток щелочной фосфатазы — признак метастатического поражения костной ткани, выявляется у 70% пациентов с генерализацией опухолевого процесса.
- ТРУЗИ и МРТ простаты. Трансректальное ультразвуковое исследование предстательной железы при гормонорезистентном раке может показать увеличение объема железы и инвазию опухоли в соседние органы. Более точную картину дает МРТ органов малого таза, которая не только демонстрирует отношение опухоли с близлежащими структурами, но и в 50-70% позволяет оценить состояние внутритазовых лимфоузлов.
- Инструментальные методы визуализации. Для поиска метастазов исследуют органы грудной клетки с помощью КТ или рентгенографии, проводят ультразвуковое сканирование, МРТ или КТ органов брюшной полости. Радиоизотопную сцинтиграфию назначают при подозрении на метастазы в кости скелета или для отслеживания динамики процесса. ПЭТ—КТ может быть выполнена пациенту с раком простаты после лечения, если метастатические очаги не определяют, а уровень ПСА продолжает расти.
Лечение гормонорезистентного рака простаты
Гормонорефрактерный рак остается одним из самых сложных диагнозов в урологии, сопровождается высокой смертностью, однако существует множество аспектов в лечении, которые позволяют увеличить продолжительность жизни и улучшить ее качество. В течение последнего десятилетия введено несколько новых методов терапии с доказанной безопасностью и эффективностью. Одобрено применение новых лекарств, которые подавляют синтез тестостерона с помощью иных механизмов действия, отличных от предшественников — антагонистов андрогеновых рецепторов 1 поколения (флутамид, бикалутамилд, нилутамид). Внедрены схемы лечения, включающие кетоконазол, эстрогены, эстрамустина фосфат, ЛГРГ, соматостатин и дексаметазон.
Несмотря на множество перспективных разработок, большинство специалистов по-прежнему рекомендуют кастрацию и прием антиандрогенов с заменой препаратов или увеличением дозы. Рассматривают следующие варианты тактики ведения в дополнение к терапии максимальной андрогенной блокады:
- Химиотерапия. Доцетаксел — первый одобренный химиотерапевтический препарат для лечения метастатического гормонорефрактерного рака простаты. Его комбинация с преднизоном считается стандартом лечения. Более современное лекарство с высокой цитотоксичностью — кабазитаксел. Это препарат второй линии, также используется в сочетании с преднизоном в случаях, когда не удалось получить адекватный ответ на терапию доцетакселом.
- Иммунотерапия. Сипулеуцел-Т — представитель нового направления (вакцинотерапии) для лечения гормонорезистентной опухоли простаты. При его введении запускается специфическая активация собственной иммунной системы, которая начинает бороться с опухолевой массой. Вакцина изготавливается для каждого пациента индивидуально, на основе взаимодействия его Т-лимфоцитов с гибридным белком.
- Современные антагонисты гормонов. Антиандрогены первого поколения могут быть заменены на абиратерона ацетат — селективный ингибитор CYP17, коэнзима цитохрома Р450, который способствует подавлению выработки внегонадного тестостерона за счет угнетения активности фермента в надпочечниках, простате, опухолевой ткани, яичках. Энзалутамид — суперселективный антиандроген, его действие направлено на максимальное подавление синтеза тестостерона после прогресса онкологического процесса на фоне терапии доцетакселом.
- Таргетная радиационная терапия. Радия-223 дихлорид — радиофармпрепарат для проведения таргетной радионуклидной терапии. Токсичность от воздействия на организм минимальна. Таргетная терапия подразумевает доставку системного излучения выборочно к опухолевой клетке. Радиофармпрепарат связывается с ионами кальция и направленно подавляет активность костных метастазов. Учитывая малодоступность препаратов для целевой радиотерапии, преимущественно используют бисфосфонаты, чтобы предупредить скелетные осложнения.
Профилактика и прогноз
Прогноз связан с несколькими факторами, включая местную распространенность опухоли, наличие висцеральных и костных метастазов. Показатели безрецидивной и общей выживаемости составляют 12-24 и 24-36 месяцев. Нет доказанной стратегии в профилактике рака простаты, но риск развития патологии можно уменьшить с помощью рационального питания, которое включает низкокалорийную диету с превалированием растительных жиров, достаточное потребление фруктов и овощей, продуктов, богатых омега-з жирными кислотами. Не менее важен здоровый образ жизни с ежедневной физической активностью, регулярные сексуальные отношения. Для своевременного выявления злокачественного новообразования простаты всем мужчинам старше 40 лет необходим ежегодный осмотр урологом.
Источник
Антиандрогенная терапия создаёт хорошие условия для развития устойчивых к ней клеток, которые в итоге занимают большую часть опухоли. Очевидно, в развитии устойчивости ключевую роль играет нарушение передачи сигнала через андрогеновые рецепторы. Возможны мутации апдрогеновых рецепторов, влияющие на экспрессию кодирующих их генов и чувствительность рецепторов к лигандам. Впрочем такие мутации находят лишь в части опухолевых клеток, и едва ли с ними можно связать все случаи устойчивости к гормонотерапии.
Важную роль в прогрессировании опухоли играют белковые факторы роста. Эпидермальный фактор роста резко усиливает пролиферацию эпителия и стромы предстательной железы. Он активно вырабатывается опухолью и действует как паракринный стимулятор роста. При устойчивости к гормонотерапии возрастает значение аутокринной стимуляции, а этот белок поддерживает неконтролируемый рост опухоли.
Опухоли, устойчивые к гормонотерапии (гормонорезистентный, гормонально-независимый или андрогеннезависимый рак предстательной железы — РПЖ), составляют весьма неоднородную группу и прогноз при них разный. Существуют два уровня устойчивости к гормонотерапии. Следует различать устойчивость к одной лишь антиандрогенной терапии, когда может помочь гормонотерапия второй линии (эстрогены, глюкокортикоиды, а также отмена антиандрогенов), и устойчивость ко всем видам гормонотерапии.
Критерии устойчивости к гормонотерапии:
- посткастрационный уровень тестостерона;
- три последовательных подъёма уровня простатоспецифичного антигена — ПСА с интервалами 2 нед, ведущие к удвоению минимального значения;
- рост уровня ПСА при проведении гормонотерапии второй линии и сопутствующей отмене антиандрогенных препаратов не менее чем на 4 нед;
- увеличение опухолевых очагов;
- уменьшение противоопухолевого эффекта.
Противоопухолевый эффект следует оценивать по стандартным критериям (RECIST). 80—90% больных не имеют измеримых опухолевых очагов, подходящих для применения этих критериев, а количество костных метастазов у них сложно оценить количественно. У больных с преобладанием внекостных метастазов прогноз обычно хуже, чем у больных с костными метастазами. Следовательно, однозначного мнения по поводу оценки эффективности гормонотерапии не существует. Наконец, у больных раком предстательной железы бывает сложно установить причину смерти, поэтому желательно учитывать общую выживаемость, а не риск смерти от опухоли.
Иногда эффект лечения оценивают по динамике уровня простатоспецифичного антигена, хотя единых критериев ремиссии (величина и длительность снижения уровня ПСА) не существует. Динамика содержания ПСА позволяет быстро оценить эффективность новых препаратов. Данные об адекватности оценки ремиссии по уровню ПСА противоречивы, иногда лечение вызывает резкие колебания уровня ПСА, что говорит о преходящем влиянии препаратов на продукцию простатоспецифичного антигена.
Таким образом, чтобы сделать вывод об эффективности препарата по динамике содержания ПСА, необходимо знать, как он влияет на выработку ПСА, а также учитывать другие клинические данные. Несмотря на эти ограничения, показано, что снижение исходного уровня ПСА в два раза и более достоверно увеличивает выживаемость. Известны молекулярные факторы прогноза (например, уровень мРНК ПСА), определяемые с помощью полимеразной цепной реакции с обратной транскрипцией. По уменьшению болей, связанных с метастазами в кости, можно оценить паллиативный эффект от лечения.
Всё чаще для оценки лечебного эффекта предлагают использовать субъективные критерии. В клинические испытания необходимо включать достаточное число больных, использовать четкие критерии эффективности и учитывать каждый из них отдельно (например, не объединять частичные и полные ремиссии), оценку по динамике уровня простатоспецифичного антигена использовать лишь в сочетании с другими параметрами, а у больных с сохранением симптомов заболевания определять качество жизни.
Клинические рекомендации по оценке эффективности
При снижении уровня ПСА на 50% и более в течение 8 нед выживаемость достоверно выше, чем у остальных больных. При наличии внекостных метастазов эффект от лечения следует оценивать по критериям RECIST. При выраженных симптомах эффективность лечения можно оценивать по их изменению.
Продолжение антиандрогенной терапии
Устойчивость к гормонотерапии означает рост опухоли на фоне кастрации. В таких случаях необходимо, прежде всего, удостовериться, действительно ли определяют посткастрационный уровень тестостерона (не выше 20—50 нг%). Обычно эффект от продолжения антиандрогенной терапии невелик. Чётких данных об увеличении выживаемости при длительном лечении нет, однако при отсутствии рандомизированных исследований следует рекомендовать пожизненную антиандрогенную терапию, поскольку её возможная польза больше, чем частота и выраженность побочных эффектов.
Гормонотерапия второй линии
Гормонотерапия при прогрессировании процесса на фоне проводимой антиандрогенной терапии включает отмену или добавление антиандрогенов, эстрогенов, ингибиторов синтеза стероидных гормонов и экспериментальных препаратов.
Отмена антиандрогенов
В 1993 г. был описан феномен снижения уровня ПСА после отмены флутамида. Это открытие имеет большое теоретическое и практическое значение. Примерно у 301 больного с прогрессированием на фоне применения антиандрогенных препаратов их отмена вызывает ремиссию (снижение уровня ПСА на 50% и более), продолжающуюся около 4 месяцев. Ремиссия описана также при отмене бикалутамида и мегестрола.
Лечение после гормонотерапии первой линии
Кроме тех случаев, когда уровень тестостерона выше посткастрационного, предсказать эффективность гормонотерапии второй линии невозможно. Для бикалутамида доказана зависимость эффекта от дозы: при опухолях, чувствительных к гормонотерапии, в дозе 200 мг/сут он снижает уровень ПСА в большей степени, чем в дозе 50 мг/сут. Однако при росте содержания простатоспецифичного антигена на фоне кастрации назначение антиандрогенов, флутамида или бикалутамида эффективно лишь у небольшой части больных.
Надпочечники продуцируют около 10% андрогенов. Несмотря на прогрессирование после кастрации, некоторые опухоли сохраняют зависимость от уровня андрогенов и дополнительное снижение их концентрации с помощью адреналэктомии или препаратов, подавляющих синтез стероидных гормонов, иногда вызывает ремиссию. Так действуют аминоглутетимид®, кетоконазол и глюкокортикоиды: у четверти больных они вызывают двукратное снижение уровня ПСА длительностью около 4 мес.
Опухолевые клетки содержат эстрогеновые рецепторы. В опытах на животных показано, что кастрация усиливает их экспрессию. В экспериментах in vitro установлено, что эстрогены способны стимулировать мутантные андрогеновые рецепторы, выделенные из опухолей, устойчивых к антиандрогенной терапии. Антиэстрогены вызывают ремиссию у 10% больных. Описаны случаи ремиссии на фоне применения высоких доз эстрогенов. Их действие связывают с нарушением митоза и прямым цитотоксическим эффектом, вероятно, за счёт индукции апоптоза. Однако даже в низких дозах диэтилстильбэстрол может вызывать тромбоз глубоких вен у 31% больных и инфаркт миокарда — у 7% пациентов.
Химиотерапия
Некоторые схемы химиотерапии показали эффективность при РПЖ, устойчивом к гормонотерапии. В двух недавних испытаниях при терапии с применением доцетаксела медиана выживаемости увеличивалась примерно на 2 мес по сравнению со схемой митоксантрон + преднизалон. Испытание ТАХ-327 включило 1006 больных, которые получали митоксантрон (по 12 мг/м2 каждые 3 нед — первая группа) или доцетаксел (по 75 мг/м2 каждые 3 нед — вторая группа; по 30 мг/м2 еженедельно 5 нед подряд с перерывом на 1 нед — третья группа).
Медиана выживаемости составила соответственно 16,5; 18,9 и 17,4 мес; частота ремиссий (снижение уровня ПСА в 2 раза и более) — 32, 45 и 48%; доля больных с выраженным уменьшением боли — 22, 35 и 31%. Побочные действия во всех трёх группах были схожими, но качество жизни на фоне доцетаксела было достоверно выше.
В испытании SWOG 99-16 674 больных получали митоксантрон (по 12 мг/м2 каждые 3 нед) или доцетаксел (по 60 мг/м2 каждые 3 нед) с эстрамустином. Медиана выживаемости составила соответственно 15,6 и 17,5 мес; медиана времени до прогрессирования — 3,2 и 6,3 мес; частота ремиссий (снижение уровня ПСА) — 27 и 50%. Уменьшение боли в обеих группах было одинаковым, но побочные действия на фоне доцетаксела возникали достоверно чаще.
Оптимальное время для начала химиотерапии неизвестно, так как её эффективность при одном лишь повышении уровня ПСА на фоне гормонотерапии не изучена. Решение о переходе к химиотерапии принимают индивидуально, иногда рекомендуют начинать её после двух последовательных подъёмов уровня простатоспецифичного антигена и достижения его уровня более 5 нг/мл.
В испытаниях по сочетанному применению таксанов с антисмысловыми олигонуклеотидами, кальцитриолом, эксизулиндом и талидомидом, частота ремиссий достигает 60%. В небольшом рандомизированном исследовании при сочетании доцетаксела (по 30 мг/м2 еженедельно 3 нед подряд с перерывом на 1 нед) и талидомида (по 200 мг/сут внутрь) частота ремиссий была выше (53%), чем при монотерапии доцетакселом (37%); медиана времени до прогрессирования составила соответственно 5,9 и 3,7 мес; полуторагодичная выживаемость — 68 и 43%. Однако дополнение терапии талидомидом повышало риск осложнений (в том числе тромбоэмболических) с 0 до 28%.
Большое внимание уделяют сочетанию митоксантрона с глюкокортикоидами при болях в костях, связанных с метастазированием. В испытании «CALGB 9182» 244 больных получали гидрокортизон или гидрокортизон с митоксантроном (по 12 мг/м2 каждые 3 нед). Частота ремиссий, время до прогрессирования и качество жизни при добавлении митоксантрона были достоверно выше.
В другом исследовании, включавшем 161 больного, добавление митоксантрона к преднизолону достоверно повышало обезболивающий эффект (29 и 12%) и длительность симптоматического эффекта (43 и 18 нед). Частота ремиссий и медиана выживаемости совпадали с таковыми без применения митоксантрона. Хотя ни одно из этих испытаний не показало увеличение выживаемости, в связи с уменьшением боли качество жизни на фоне митоксантроиа было достоверно улучшено.
В предварительных испытаниях хорошие результаты показали конъюгированный доксорубицин, схемы паклитаксел + карбоплатин + эстрамустин, винбластин + доксорубицин в сочетании с изотопами, доцетаксел + митоксантрон. Рандомизированные ислледования не были проведены.
Клинические рекомендации по симптоматической терапии
Для профилактики осложнений при метастазах в кости рекомендованы бисфосфонаты (золедроновая кислота). Симптоматическую терапию (введение изотопов, дистанционное облучение, анальгетики) следует назначать при первом возникновении боли в костях.
Прогноз
Несмотря на многочисленные попытки применения тканевых и сывороточных маркёров, наиболее важными факторами прогноза заболевания опухоли считают степень дифференцировки опухолевых клеток и стадию заболевания. У больных с высокодифференцированной опухолью отмечают высокую опухольспецифическую выживаемость. У больных с низкодифференцированной опухолью либо при локализованном РПЖ с прорастанием капсулы предстательной железы (Т3) прогноз крайне неблагоприятный.
Ю.Г. Аляев
Опубликовал Константин Моканов
Источник

